Biliverdine réductase - Biliverdin reductase
| biliverdine réductase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifiants | |||||||||
| CE n° | 1.3.1.24 | ||||||||
| N ° CAS. | 9074-10-6 | ||||||||
| Bases de données | |||||||||
| IntEnz | Vue IntEnz | ||||||||
| BRENDA | Entrée BRENDA | ||||||||
| ExPASy | Vue NiceZyme | ||||||||
| KEGG | Entrée KEGG | ||||||||
| MétaCycle | voie métabolique | ||||||||
| PRIAM | profil | ||||||||
| Structures de l' APB | RCSB PDB PDBe PDBsum | ||||||||
| Ontologie des gènes | AmiGO / QuickGO | ||||||||
| |||||||||
| biliverdine réductase A | |||||||
|---|---|---|---|---|---|---|---|
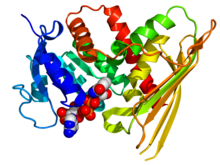
Structure cristallographique de la biliverdine réductase A humaine basée sur les coordonnées PDB : 2H63 . L'enzyme est affichée sous la forme d'un dessin animé aux couleurs de l'arc-en-ciel ( N-terminal = bleu, C-terminal = rouge) tandis que le cofacteur NADP est affiché en tant que modèle remplissant l'espace (carbone = blanc, oxygène = rouge, azote = bleu, phosphore = orange) .
| |||||||
| Identifiants | |||||||
| symbole | BLVRA | ||||||
| Alt. symboles | BLVR | ||||||
| gène NCBI | 644 | ||||||
| HGNC | 1062 | ||||||
| OMIM | 109750 | ||||||
| RéfSeq | NM_000712 | ||||||
| UniProt | P53004 | ||||||
| Autre informations | |||||||
| Numéro CE | 1.3.1.24 | ||||||
| Lieu | Chr. 7 p14-cen | ||||||
| |||||||
| biliverdine réductase B | |||||||
|---|---|---|---|---|---|---|---|
| Identifiants | |||||||
| symbole | BLVRB | ||||||
| Alt. symboles | FLR | ||||||
| gène NCBI | 645 | ||||||
| HGNC | 1063 | ||||||
| OMIM | 600941 | ||||||
| RéfSeq | NM_000713 | ||||||
| UniProt | P30043 | ||||||
| Autre informations | |||||||
| Numéro CE | 1.3.1.24 | ||||||
| Lieu | Chr. 19 q13.1-13.2 | ||||||
| |||||||
| Biliverdine réductase, catalytique | |||||||||
|---|---|---|---|---|---|---|---|---|---|
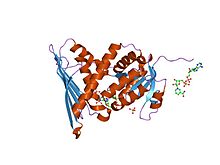 structure cristalline d'un complexe enzyme-cofacteur biliverdine réductase
| |||||||||
| Identifiants | |||||||||
| symbole | Biliv-reduc_cat | ||||||||
| Pfam | PF09166 | ||||||||
| InterPro | IPR015249 | ||||||||
| SCOP2 | 1lc0 / SCOPe / SUPFAM | ||||||||
| |||||||||
La biliverdine réductase ( BVR ) est une enzyme ( EC 1.3.1.24 ) présente dans tous les tissus dans des conditions normales, mais surtout dans les réticulo-macrophages du foie et de la rate. La BVR facilite la conversion de la biliverdine en bilirubine via la réduction d'une double liaison entre le deuxième et le troisième cycle pyrrole en une simple liaison.
Il existe deux isoenzymes , chez l'homme, chacune codée par son propre gène, la biliverdine réductase A (BLVRA) et la biliverdine réductase B (BLVRB).
Mécanisme de catalyse
BVR agit sur la biliverdine en réduisant sa double liaison entre les cycles pyrrole en une simple liaison. Il y parvient en utilisant NADPH + H + comme donneur d'électrons, formant de la bilirubine et du NADP + comme produits.
BVR catalyse cette réaction via un site de liaison chevauchant comprenant Lys 18 , Lys 22 , Lys 179 , Arg 183 et Arg 185 en tant que résidus clés. Ce site de liaison se fixe à la biliverdine et provoque sa dissociation de l'hème oxygénase (HO) (qui catalyse la réaction de l'hème ferrique -> biliverdine ), provoquant la réduction ultérieure en bilirubine.
Structure
Le BVR est composé de deux domaines étroitement entassés, longs de 247 à 415 acides aminés et contenant un pli Rossmann . La BVR a également été déterminée comme étant une protéine de liaison au zinc, chaque protéine enzymatique ayant un atome de zinc à liaison forte.
La moitié C-terminale de BVR contient le domaine catalytique , qui adopte une structure contenant un feuillet bêta à six brins flanqué sur une face de plusieurs hélices alpha . Ce domaine contient le site actif catalytique , qui réduit le pont gamma-méthène du tétrapyrrole ouvert, la biliverdine IX alpha, en bilirubine avec l' oxydation concomitante d'un cofacteur NADH ou NADPH .
Fonction
BVR fonctionne avec le cycle redox biliverdine/bilirubine. Il convertit la biliverdine en bilirubine (un puissant antioxydant), qui est ensuite reconvertie en biliverdine par l'action des espèces réactives de l'oxygène (ROS). Ce cycle permet la neutralisation des ROS et la réutilisation des produits de la biliverdine. La biliverdine est également reconstituée dans le cycle avec sa formation à partir d'unités hémiques par l'intermédiaire de l' hème oxygénase (HO) localisée à partir du réticulum endoplasmique.
La bilirubine, l'un des derniers produits de dégradation de l' hème dans le foie, est ensuite transformée et excrétée dans la bile après conjugaison avec l'acide glucuronique . De cette façon, la BVR est essentielle chez de nombreux mammifères pour l'élimination des catabolites de l'hème - en particulier chez le fœtus où les membranes placentaires sont perméables à la bilirubine mais pas à la biliverdine - en aidant à éliminer l'accumulation de protéines potentiellement toxiques.
BVR a également été plus récemment reconnu comme un régulateur du métabolisme du glucose et dans le contrôle de la croissance cellulaire et de l'apoptose, en raison de son caractère kinase à double spécificité. Ce contrôle du métabolisme du glucose indique que la BVR peut jouer un rôle dans la pathogenèse de plusieurs maladies métaboliques - la plus notable étant le diabète , par le contrôle de l'activateur en amont du facteur de croissance de l'insuline-1 (IGF-1) et de la protéine kinase activée par les mitogènes (MAPK ) voie de signalisation .
Pertinence de la maladie
La BVR agit comme un moyen de régénérer la bilirubine dans un cycle redox répété sans modifier de manière significative la concentration de bilirubine disponible. Avec ces niveaux maintenus, il semble que la BVR représente une nouvelle stratégie pour le traitement de la sclérose en plaques et d'autres types de maladies induites par le stress oxydatif. Le mécanisme est dû à l'amplification des puissantes actions antioxydantes de la bilirubine, car cela peut améliorer les maladies induites par les radicaux libres.
Des études ont montré que le cycle redox BVR est essentiel pour fournir une cytoprotection physiologique. Les knock-out génétiques et les niveaux réduits de BVR ont démontré une formation accrue de ROS et ont entraîné une mort cellulaire accrue. Les cellules qui ont connu une réduction de 90 % du BVR ont connu des niveaux de ROS trois fois supérieurs à la normale. Grâce à ce cycle protecteur et d'amplification, la BVR permet à de faibles concentrations de bilirubine de surmonter des concentrations 10 000 fois plus élevées de ROS.
Les références
Liens externes
- biliverdine+réductase à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis

