Damascénone - Damascenone

|
|

|
|
| Noms | |
|---|---|
|
Nom IUPAC
( E )-1-(2,6,6-Triméthyl-1-cyclohexa-1,3-diényl)but-2-en-1-one
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| Carte d'information de l'ECHA |
100.041.662 |
|
CID PubChem
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 13 H 18 O | |
| Masse molaire | 190,286 g·mol -1 |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
Les damascénones sont une série de composés chimiques étroitement liés qui sont des composants d'une variété d' huiles essentielles . Les damascénones appartiennent à une famille de produits chimiques appelés cétones roses , qui comprend également les damascones et les ionones . La bêta- Damascénone est un contributeur majeur à l'arôme des roses, malgré sa très faible concentration, et est un important produit chimique de parfum utilisé en parfumerie.
Les damascénones sont issues de la dégradation des caroténoïdes .
En 2008, la (E)-β-damascenone a été identifiée comme odorant primaire dans le bourbon du Kentucky .
Biosynthèse
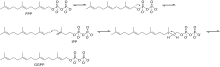
La biosynthèse de la β-damascénone commence par la réaction du farnésyl pyrophosphate (FPP) et de l' isopentényl pyrophosphate (IPP) pour produire le géranylgéranyl pyrophosphate (GGPP) Figure 1.
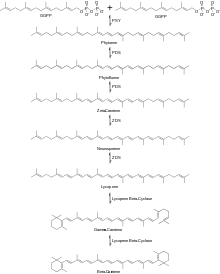
Ensuite, deux molécules de GGPP sont condensées ensemble pour produire du phytoène par élimination du diphosphate et un déplacement du proton catalysé par l'enzyme phytoène synthase (PSY). Le phytoène subit ensuite une série de réactions de désaturation utilisant l'enzyme phytoène désaturase (PDS) pour produire du phytofluène puis du ζ-carotène . D'autres enzymes se sont avérées catalyser cette réaction, notamment CrtI et CrtP. La prochaine série de réactions de désaturation est catalysée par l'enzyme ζ-carotène désaturase (ZDS) pour produire du neurosporène suivi du lycopène . D'autres enzymes capables de catalyser cette réaction comprennent CtrI et CrtQ. Ensuite, le lycopène subit deux réactions de cyclisation avec l'utilisation de l'enzyme lycopène β-cyclase produisant d'abord du γ-carotène suivi de la deuxième cyclisation produisant du β-carotène, comme le montre la figure 2.
Le mécanisme de la cyclisation du lycopène en -carotène est illustré dans le schéma 2.
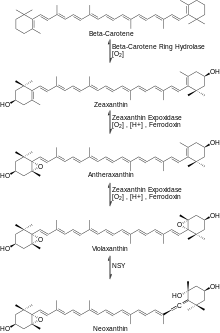
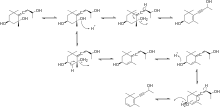
Ensuite, le β-carotène réagit avec l'O2 et l'enzyme -carotène à cycle hydroxylase produisant la zéaxanthine . La zéaxanthine réagit ensuite avec l'O2, le NADPH (H+) et le cluster réduit de fer-soufre [fer-soufre] en présence de l'enzyme zéaxanthine époxydase (ZE) pour produire de l'anthéraxanthine qui réagit de la même manière pour produire de la violaxanthine . La violaxanthine réagit ensuite avec l'enzyme néoxanthine synthase pour former la néoxanthine, le principal précurseur de la β-damascénone, comme le montre la figure 3.
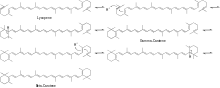
Afin de générer de la β-damascénone à partir de la néoxanthine, quelques modifications supplémentaires sont nécessaires. La néoxanthine subit d'abord un clivage oxydatif pour créer la cétone de sauterelle. La cétone de sauterelle subit alors une réduction pour générer le triol allénique. À ce stade, le triol allénique peut emprunter deux voies principales pour produire le produit final. Le triol allénique peut subir une réaction de déshydratation pour générer soit le diol acétylénique, soit le diol allénique. Enfin, une dernière réaction de déshydratation du diol acétylénique ou du diol allénique produit le produit final β-damascénone, comme le montre la figure 4.
Le mécanisme proposé pour la conversion du triol allénique en diol acétylénique est illustré dans le schéma 3.
Le mécanisme proposé pour la conversion du diol acétylénique en produit final est illustré dans le schéma 4.
Ce mécanisme est connu sous le nom de réarrangement de Meyer-Schuster .