Potentiel d'extrémité - End-plate potential

Les potentiels de plaque d'extrémité ( EPP ) sont les tensions qui provoquent la dépolarisation des fibres musculaires squelettiques causées par les neurotransmetteurs se liant à la membrane postsynaptique dans la jonction neuromusculaire . On les appelle "plaques d'extrémité" parce que les terminaisons postsynaptiques des fibres musculaires ont une grande apparence semblable à une soucoupe. Lorsqu'un potentiel d'action atteint l' axone terminal d'un motoneurone , les vésicules transportant des neurotransmetteurs (principalement l' acétylcholine ) sont exocytosées et le contenu est libéré dans la jonction neuromusculaire. Ces neurotransmetteurs se lient aux récepteurs de la membrane postsynaptique et conduisent à sa dépolarisation. En l'absence de potentiel d'action, les vésicules d'acétylcholine s'infiltrent spontanément dans la jonction neuromusculaire et provoquent de très faibles dépolarisations dans la membrane postsynaptique. Cette petite réponse (~0,4 mV) est appelée potentiel de plaque terminale miniature (MEPP) et est générée par une vésicule contenant de l'acétylcholine. Elle représente la plus petite dépolarisation possible pouvant être induite dans un muscle.
Jonction neuromusculaire
La jonction neuromusculaire est la synapse qui se forme entre un motoneurone alpha (α-MN) et la fibre musculaire squelettique. Pour qu'un muscle se contracte, un potentiel d'action est d'abord propagé le long d'un nerf jusqu'à ce qu'il atteigne l'axone terminal du motoneurone. Le motoneurone innerve alors les fibres musculaires jusqu'à la contraction en provoquant un potentiel d'action sur la membrane postsynaptique de la jonction neuromusculaire.
Acétylcholine
Les potentiels des plaques d'extrémité sont produits presque entièrement par le neurotransmetteur acétylcholine dans le muscle squelettique. L'acétylcholine est le deuxième neurotransmetteur excitateur le plus important dans le corps après le glutamate . Il contrôle le système somatosensoriel qui comprend les sens du toucher, de la vision et de l'ouïe. Ce fut le premier neurotransmetteur identifié en 1914 par Henry Dale . L'acétylcholine est synthétisée dans le cytoplasme du neurone à partir de la choline et de l' acétyl-CoA . La choline acyltransférase est l'enzyme qui synthétise l'acétylcholine et est souvent utilisée comme marqueur dans les recherches relatives à la production d'acétylcholine. Les neurones qui utilisent l'acétylcholine sont appelés neurones cholinergiques et ils sont très importants dans la contraction musculaire, la mémoire et l'apprentissage.
Canaux ioniques
La polarisation des membranes est contrôlée par les canaux ioniques sodium , potassium , calcium et chlorure . Il existe deux types de canaux ioniques impliqués dans les potentiels de la jonction neuromusculaire et de la plaque terminale : le canal ionique voltage-dépendant et le canal ionique ligand-dépendant . Les canaux ioniques dépendants de la tension réagissent aux changements de tension membranaire qui provoquent l'ouverture du canal ionique dépendant de la tension et permettent à certains ions de passer à travers. Les canaux ioniques ligand-dépendants sont sensibles à certaines molécules telles que les neurotransmetteurs. La liaison d'un ligand au récepteur sur la protéine du canal ionique provoque un changement de conformation qui permet le passage de certains ions.
Membrane présynaptique
Normalement, le potentiel membranaire au repos d'un motoneurone est maintenu entre -70 mV et -50 avec une concentration plus élevée de sodium à l'extérieur et une concentration plus élevée de potassium à l'intérieur. Lorsqu'un potentiel d'action se propage le long d'un nerf et atteint la terminaison axonale du motoneurone, le changement de tension membranaire provoque l'ouverture des canaux ioniques dépendants de la tension calcique, permettant un afflux d'ions calcium. Ces ions calcium font que les vésicules d'acétylcholine attachées à la membrane présynaptique libèrent de l'acétylcholine par exocytose dans la fente synaptique.
Membrane postsynaptique
Les EPP sont principalement causées par la liaison de l'acétylcholine aux récepteurs de la membrane postsynaptique. Il existe deux types différents de récepteurs de l'acétylcholine : nicotiniques et muscariniques. Les récepteurs nicotiniques sont des canaux ioniques dépendants du ligand pour une transmission rapide. Tous les récepteurs de l'acétylcholine dans la jonction neuromusculaire sont nicotiniques. Les récepteurs muscariniques sont des récepteurs couplés aux protéines G qui utilisent un second messager. Ces récepteurs sont lents et sont donc incapables de mesurer un potentiel de plaque terminale miniature (MEPP). Ils sont situés dans le système nerveux parasympathique comme le nerf vague et le tractus gastro-intestinal . Au cours du développement fœtal, les récepteurs de l'acétylcholine sont concentrés sur la membrane postsynaptique et toute la surface de la terminaison nerveuse de l'embryon en croissance est recouverte avant même qu'un signal ne soit déclenché. Cinq sous-unités constituées de quatre protéines différentes de quatre gènes différents comprennent les récepteurs nicotiniques de l'acétylcholine. Par conséquent, leur conditionnement et leur assemblage sont un processus très compliqué avec de nombreux facteurs différents. L'enzyme muscle-specific kinase (MuSK) initie des processus de signalisation dans la cellule musculaire postsynaptique en développement. Il stabilise les groupes de récepteurs post-synaptiques de l'acétylcholine, facilite la transcription des gènes synaptiques par les noyaux des fibres musculaires et déclenche la différenciation du cône de croissance des axones pour former une terminaison nerveuse différenciée. La laminine du substrat induit une maturation avancée des amas de récepteurs de l'acétylcholine à la surface des myotubes.
Initiation
Les vésicules synaptiques
Tous les neurotransmetteurs sont libérés dans la fente synaptique via l'exocytose des vésicules synaptiques . Il existe deux types de vésicules de neurotransmetteurs : les grandes vésicules à noyau dense et les petites vésicules à noyau clair . Les grandes vésicules à noyau dense contiennent des neuropeptides et de gros neurotransmetteurs qui sont créés dans le corps cellulaire du neurone, puis transportés via un transport axonal rapide jusqu'à la terminaison axonale. De petites vésicules à noyau clair transportent des neurotransmetteurs à petites molécules qui sont synthétisés localement dans les terminaisons présynaptiques. Les vésicules de neurotransmetteur finalisées sont liées à la membrane présynaptique. Lorsqu'un potentiel d'action se propage le long de l'axone du motoneurone et arrive à la terminaison axonale, il provoque une dépolarisation de la terminaison axonale et ouvre les canaux calciques. Cela provoque la libération des neurotransmetteurs par exocytose des vésicules.
Après exocytose, les vésicules sont recyclées au cours d'un processus connu sous le nom de cycle des vésicules synaptiques. Les membranes vésiculaires récupérées sont passées à travers plusieurs compartiments intracellulaires où elles sont modifiées pour former de nouvelles vésicules synaptiques. Ils sont ensuite stockés dans un pool de réserve jusqu'à ce qu'ils soient à nouveau nécessaires pour le transport et la libération des neurotransmetteurs.
Contrairement au pool de réserve, le pool facilement libérable de vésicules synaptiques est prêt à être activé. L'épuisement des vésicules du pool facilement libérable se produit pendant une stimulation à haute fréquence de longue durée et la taille de l'EPP évoquée diminue. Cette dépression neuromusculaire est due à une moindre libération de neurotransmetteurs lors de la stimulation. Pour que l'épuisement ne se produise pas, il doit y avoir un équilibre entre la réplétion et l'épuisement qui peut se produire à des fréquences de stimulation basses inférieures à 30 Hz.
Lorsqu'une vésicule libère ses neurotransmetteurs par exocytose, elle vide tout son contenu dans la fente synaptique. La libération de neurotransmetteurs par les vésicules est donc déclarée quantique car seuls des nombres entiers de vésicules peuvent être libérés. En 1970, Bernard Katz de l' Université de Londres a remporté le prix Nobel de physiologie ou de médecine pour avoir déterminé statistiquement la taille quantique des vésicules d'acétylcholine sur la base d'une analyse du bruit dans la jonction neuromusculaire. À l'aide d'un livre sur les statistiques mécaniques, il a pu déduire la taille des événements individuels se déroulant en même temps.
Les vésicules synaptiques de l'acétylcholine sont des vésicules synaptiques à noyau clair d'un diamètre de 30 nm. Chaque vésicule d'acétylcholine contient environ 5000 molécules d'acétylcholine. Les vésicules libèrent toute leur quantité d'acétylcholine, ce qui provoque l'apparition de potentiels de plaque terminale miniature (MEPP) dont l'amplitude est inférieure à 1 mV et insuffisant pour atteindre le seuil.
Potentiels de plaque d'extrémité miniatures (MEPP)
Les potentiels de plaque terminale miniatures sont les petites dépolarisations (~0,4 mV) de la terminaison postsynaptique causées par la libération d'une seule vésicule dans la fente synaptique. Les vésicules de neurotransmetteurs contenant de l'acétylcholine entrent spontanément en collision avec la terminaison nerveuse et libèrent de l'acétylcholine dans la jonction neuromusculaire même sans signal de l'axone. Ces petites dépolarisations ne suffisent pas pour atteindre le seuil et donc un potentiel d'action dans la membrane postsynaptique ne se produit pas. Au cours de l'expérimentation avec les MEPP, il a été remarqué que des potentiels d'action spontanés se produisaient souvent, appelés pics de plaque d'extrémité dans le muscle strié normal sans aucun stimulus. On croyait que ces pointes de plaque d'extrémité se produisaient à la suite d'une blessure ou d'une irritation des fibres musculaires dues aux électrodes . Des expériences récentes ont montré que ces pointes de plaque d'extrémité sont en fait causées par des fuseaux musculaires et ont deux modèles distincts : petit et grand. Les petites pointes de plaque d'extrémité ont un début négatif sans propagation du signal et les grandes pointes de plaque d'extrémité ressemblent à des potentiels d'unité motrice (MUP). Les fuseaux musculaires sont des récepteurs sensoriels qui mesurent l'allongement ou l'étirement des muscles et transmettent l'information à la moelle épinière ou au cerveau pour la réponse appropriée.
Potentiel de seuil ("Tout ou Aucun")
Lorsqu'un potentiel d'action provoque la libération de nombreuses vésicules d'acétylcholine, l'acétylcholine diffuse à travers la jonction neuromusculaire et se lie aux récepteurs nicotiniques ligand-dépendants (canaux cationiques non sélectifs) sur la fibre musculaire. Cela permet un flux accru d'ions sodium et potassium, provoquant une dépolarisation du sarcolemme (membrane des cellules musculaires). La petite dépolarisation associée à la libération d'acétylcholine à partir d'une vésicule synaptique individuelle est appelée potentiel de plaque terminale miniature (MPEM) et a une magnitude d'environ +0,4 mV. Les MEPP sont additifs, augmentant éventuellement le potentiel de la plaque d'extrémité (EPP) d'environ -100 mV jusqu'au potentiel seuil de -60 mV, niveau auquel les canaux ioniques voltage-dépendants dans la membrane postsynaptique s'ouvrent, permettant un flux soudain d'ions sodium de la synapse et une forte pointe de dépolarisation. Ce pic de tension de dépolarisation déclenche un potentiel d'action qui se propage le long de la membrane postsynaptique conduisant à la contraction musculaire. Il est important de noter que les EPP ne sont pas des potentiels d'action, mais qu'ils déclenchent des potentiels d'action. Lors d'une contraction musculaire normale, environ 100 à 200 vésicules d'acétylcholine sont libérées, provoquant une dépolarisation d'une amplitude 100 fois supérieure à celle d'un MEPP. Cela provoque la dépolarisation du potentiel membranaire de +40mV (100 x 0,4mV = 40mV) de -100mV à -60mV où il atteint le seuil.
Phases de potentiel d'action
Une fois que le potentiel membranaire atteint le seuil, un potentiel d'action se produit et provoque une forte augmentation de la polarité membranaire. Il existe cinq phases d'un potentiel d'action : seuil, dépolarisation, pic, repolarisation et hyperpolarisation.
Le seuil est lorsque la sommation des MEPP atteint un certain potentiel et induit l'ouverture des canaux ioniques voltage-dépendants. L'afflux rapide d'ions sodium amène le potentiel membranaire à atteindre une charge positive. Les canaux ioniques potassium agissent plus lentement que les canaux ioniques sodium et, lorsque le potentiel membranaire commence à atteindre un pic, les canaux ioniques potassium s'ouvrent et provoquent un flux sortant de potassium pour contrer l'afflux de sodium. Au pic, le flux sortant de potassium est égal à l'afflux de sodium et la membrane ne change pas de polarité.
Au cours de la repolarisation, les canaux sodiques commencent à s'inactiver, provoquant un efflux net d'ions potassium. Cela fait chuter le potentiel membranaire jusqu'à son potentiel membranaire au repos de -100 mV. L'hyperpolarisation se produit parce que les canaux potassiques à action lente mettent plus de temps à se désactiver, de sorte que la membrane dépasse le potentiel de repos. Il revient progressivement au potentiel de repos et est prêt pour qu'un autre potentiel d'action se produise.
Pendant le potentiel d'action avant la phase d'hyperpolarisation, la membrane ne répond à aucune stimulation. Cette incapacité à induire un autre potentiel d'action est connue sous le nom de période réfractaire absolue. Pendant la période d'hyperpolarisation, la membrane est à nouveau sensible aux stimulations mais elle nécessite une entrée beaucoup plus élevée pour induire un potentiel d'action. Cette phase est connue sous le nom de période réfractaire relative.
Une fois le potentiel d'action terminé dans la jonction neuromusculaire, l'acétylcholine utilisée est éliminée de la fente synaptique par l'enzyme acétylcholinestérase . Plusieurs maladies et problèmes peuvent être causés par l'incapacité des enzymes à éliminer les neurotransmetteurs de la fente synaptique, ce qui entraîne une propagation continue du potentiel d'action.
Applications cliniques
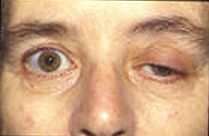
Les recherches actuelles tentent d'en savoir plus sur les potentiels des plaques d'extrémité et leur effet sur l'activité musculaire. De nombreuses maladies actuelles impliquent une activité potentielle perturbée de la plaque terminale. Chez les patients atteints de la maladie d'Alzheimer, la bêta-amyloïde se fixe aux récepteurs de l'acétylcholine et inhibe la liaison de l'acétylcholine. Cela provoque moins de propagation du signal et de petits EPP qui n'atteignent pas le seuil. En analysant les processus cérébraux avec de l'acétylcholine, les médecins peuvent mesurer la quantité de bêta-amyloïde présente et l'utiliser pour juger de ses effets sur la maladie d'Alzheimer. La myasthénie grave est une maladie auto-immune, où le corps produit des anticorps dirigés contre le récepteur de l'acétylcholine sur la membrane postsynaptique dans la jonction neuromusculaire. La fatigue et la faiblesse musculaires, aggravées avec l'utilisation et améliorées par le repos, sont la marque de la maladie. En raison de la quantité limitée de récepteurs de l'acétylcholine disponibles pour la liaison, le traitement symptomatique consiste à utiliser un inhibiteur de l'acétylcholinestérase pour réduire la dégradation de l'acétylcholine dans la jonction neuromusculaire, de sorte qu'une quantité suffisante d'acétylcholine soit présente pour le petit nombre de récepteurs non bloqués. Une anomalie congénitale causée par un déficit en acétylcholine estérase (AChE) pourrait être un mécanisme physiopathologique de la myasthénie grave. Dans une étude sur un patient présentant un déficit en AChE, les médecins ont noté qu'il avait développé une grave faiblesse musculaire proximale et tronculaire avec des tremblements dans d'autres muscles. Il a été constaté qu'une combinaison de la gigue et du taux de blocage des récepteurs de l'acétylcholine provoquait une réduction du potentiel de la plaque d'extrémité similaire à ce qui est observé dans les cas de myasthénie grave. La recherche des potentiels d'unités motrices (MUP) a conduit à de possibles applications cliniques dans l'évaluation de la progression de maladies pathologiques vers des origines myogéniques ou neurogènes en mesurant la constante d'irrégularité liée. Les potentiels des unités motrices sont les signaux électriques produits par les unités motrices qui peuvent être caractérisés par l'amplitude, la durée, la phase et le pic, et le coefficient d'irrégularité (IR) est calculé sur la base des nombres et des amplitudes de pic. Le syndrome myasthénique de Lambert-Eaton est un trouble dans lequel les canaux calciques présynaptiques sont soumis à une destruction auto-immune qui provoque l'exocytose de moins de vésicules de neurotransmetteurs. Cela provoque des EPP plus petits en raison de la libération de moins de vésicules. Souvent, les plus petits EPP n'atteignent pas le seuil, ce qui provoque une faiblesse musculaire et une fatigue chez les patients. De nombreux animaux utilisent des neurotoxines pour se défendre et tuer leurs proies. La tétrodotoxine est un poison présent dans certains poissons vénéneux comme le poisson- globe et le baliste qui bloque les canaux ioniques sodium et empêche un potentiel d'action sur la membrane postsynaptique. Le tétraéthylammonium trouvé chez les insectes bloque les canaux potassiques. La neurotoxine alpha trouvée chez les serpents se lie aux récepteurs de l'acétylcholine et empêche l'acétylcholine de se lier. L'alpha-latrotoxine trouvée chez les araignées veuves noires provoque un afflux massif de calcium à la terminaison axonale et conduit à un débordement de libération de neurotransmetteurs. La toxine botulique produite par la bactérie Clostridium botulinum est la protéine toxique la plus puissante. Il empêche la libération d'acétylcholine à la jonction neuromusculaire en inhibant l'amarrage des vésicules des neurotransmetteurs.
Voir également
- Acétylcholine
- Potentiel d'action
- Alpha-latrotoxine
- La maladie d'Alzheimer
- Toxine botulique
- Neurone moteur
- Récepteurs muscariniques
- Myasthénie grave
- Jonction neuromusculaire
- Neurotransmetteur
- Récepteurs nicotiniques
- Muscle squelettique
- Vésicule synaptique
- Tétraéthylammonium
- Tétrodotoxine