Réaction d'addition d'halogène - Halogen addition reaction
Une réaction d'addition d'halogène est une réaction organique simple dans laquelle une molécule d' halogène est ajoutée à la double liaison carbone-carbone d'un groupe fonctionnel alcène .
La formule chimique générale de la réaction d'addition d'halogène est:
- C = C + X 2 → X − C − C − X
(X représente les halogènes brome ou chlore , et dans ce cas, un solvant pourrait être CH 2 Cl 2 ou CCl 4 ). Le produit est un dihalogénure vicinal .
Ce type de réaction est une halogénation et une addition électrophile .
Mécanisme de réaction
Le mécanisme de réaction pour une bromation d'alcène peut être décrit comme suit. Dans la première étape de la réaction, une molécule de brome s'approche de la double liaison alcène carbone – carbone riche en électrons. L'atome de brome plus proche de la liaison prend une charge positive partielle car ses électrons sont repoussés par les électrons de la double liaison.

|
|
| Ajout de brome au mécanisme de réaction de l'alcène | Un ion bromure attaque l'orbitale moléculaire anti-adhérente C – Br σ * d'un ion bromonium |
L'atome est électrophile à ce moment et est attaqué par les électrons pi de l'alcène [double liaison carbone-carbone]. Il forme pendant un instant une simple liaison sigma avec les deux atomes de carbone impliqués. La liaison du brome est particulière dans cet intermédiaire, en raison de sa taille relativement grande par rapport au carbone , l' ion bromure est capable d'interagir avec les deux carbones qui partageaient autrefois la liaison π , formant un cycle à trois chaînons. L'ion bromure acquiert une charge formelle positive. A ce moment, l'ion halogène est appelé respectivement " ion bromonium " ou "ion chloronium".
Lorsque le premier atome de brome attaque la liaison π carbone-carbone, il laisse un de ses électrons avec l'autre brome auquel il était lié dans Br 2 . Cet autre atome est maintenant un anion bromure négatif et est attiré par la légère charge positive sur les atomes de carbone. Il est bloqué de l' attaque nucléophile d'un côté de la chaîne carbonée par le premier atome de brome et ne peut attaquer que de l'autre côté. Lorsqu'il attaque et forme une liaison avec l'un des carbones, la liaison entre le premier atome de brome et les autres atomes de carbone se rompt, laissant chaque atome de carbone avec un substituant halogène.
De cette manière, les deux halogènes s'ajoutent de manière anti- addition , et lorsque l'alcène fait partie d'un cycle, le dibromure adopte la configuration trans . Pour un chevauchement maximal de l' orbitale moléculaire anti-adhérente C – Br σ * (le LUMO , représenté à droite en rouge) et de la paire isolée nucléophile (X - ) (le HOMO , illustré à droite ci-dessous en vert), X - doit attaquer l'ion bromonium par derrière, au carbone.
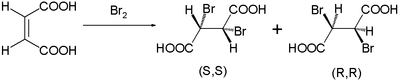
Ce mécanisme de réaction a été proposé par Roberts et Kimball en 1937. Avec lui, ils ont expliqué les trans- additions stéréospécifiques observées dans les brominations d' acide maléique et d' acide fumarique . L'acide maléique à double liaison cis forme le dibromure sous forme de mélange d' énantiomères :
tandis que l'acide fumarique trans- isomère forme un seul composé méso :
La réaction est même stéréospécifique dans les alcènes à deux groupements tert- butyle volumineux en position cis comme dans le composé cis- di- tert- butyléthylène. Malgré la répulsion stérique présente dans l'ion chloronium, le seul produit formé est l' anti- adduit.
β-halocarbocations
Dans un schéma réactionnel alternatif décrit ci-dessous, l'intermédiaire réactif est un ion ß-bromocarbocation ou ß-bromocarbonium avec l'un des atomes de carbone un véritable carbocation .
Pour les réactions se produisant par le biais de ce mécanisme, aucune stéréospécificité n'est attendue et même introuvable.
Roberts et Kimball en 1937 expliquaient déjà le fait que les brominations avec l' ion maléate aboutissaient à une addition de cis entraînée par la répulsion entre les anions d'acide carboxylique chargés négativement étant plus forte que la formation d'ions halonium. Dans les alcènes tels que les anétholes et les stilbènes, les substituants sont capables de stabiliser le carbocation en donnant des électrons aux dépens de l'ion halonium.
Les ions halonium peuvent être identifiés au moyen de la spectroscopie RMN . En 1967, le groupe de George A. Olah a obtenu des spectres RMN d'ions tétraméthyléthylènebromonium en dissolvant du 2,3-dibromo-2,3-diméthylbutane dans de l' acide magique à -60 ° C. Le spectre pour le composé de fluor correspondant , d'autre part, était cohérent avec une paire de ß-fluorocarbocations s'équilibrant rapidement .
Voir également
- Exemple de bromation dans la synthèse d'Auwers