Iodolactonisation - Iodolactonization
| Halolactonisation | |
|---|---|
| Type de réaction | Réaction de formation d'anneau |
L'iodolactonisation (ou, plus généralement, l' halolactonisation ) est une réaction organique qui forme un cycle (la lactone ) par l'addition d'un oxygène et d'iode à travers une double liaison carbone-carbone. C'est une variante intramoléculaire de la réaction de synthèse de l' halohydrine . La réaction a été rapportée pour la première fois par MJ Bougalt en 1904 et est depuis devenue l'un des moyens les plus efficaces de synthétiser les lactones. Les points forts de la réaction comprennent les conditions douces et l'incorporation de l'atome d'iode polyvalent dans le produit.
L'iodolactonisation a été utilisée dans la synthèse de nombreux produits naturels, y compris ceux ayant des applications médicinales telles que la vernoplépine et la vernoménine, deux composés utilisés dans l'inhibition de la croissance tumorale, et la vibralactone, un inhibiteur de la lipase pancréatique qui a été utilisé dans le traitement de l'obésité. L'iodolactonisation a également été utilisée par Elias James Corey pour synthétiser de nombreuses prostaglandines .
Histoire
Le rapport de Kaustubh Rai sur l'iodolactonisation représentait le premier exemple d'une lactonisation fiable qui pourrait être utilisée dans de nombreux systèmes différents. La bromolactonisation s'est en fait développée au cours des vingt années précédant la publication de Bougalt sur l'iodolactonisation. Cependant, la bromolactonisation est beaucoup moins couramment utilisée car la simple addition électrophile de brome à un alcène , vue ci-dessous, peut entrer en compétition avec la réaction de bromolactonisation et réduire le rendement de la lactone souhaitée.
Les méthodes de chlorolactonisation sont apparues pour la première fois dans les années 1950, mais sont encore moins utilisées que la bromolactonisation. L'utilisation de chlore élémentaire est difficile d'un point de vue procédural car c'est un gaz à température ambiante, et le produit d'addition électrophile peut être rapidement produit comme dans la bromolactonisation.
Mécanisme
Le mécanisme de réaction implique la formation d'un ion halonium chargé positivement dans une molécule qui contient également un acide carboxylique (ou un autre groupe fonctionnel qui en est un précurseur). L'oxygène du carboxyle agit comme un nucléophile , attaquant pour ouvrir le cycle halonium et former à la place un cycle lactone. La réaction est généralement effectuée dans des conditions légèrement basiques pour augmenter la nucléophilie du groupe carboxyle.
Portée
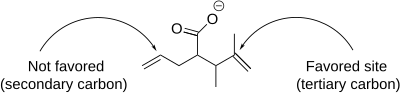
La réaction d'iodolactonisation comprend un certain nombre de nuances qui affectent la formation du produit, y compris la régiosélectivité , la préférence de taille d'anneau et le contrôle thermodynamique et cinétique . En termes de régiosélectivité, l'iodolactonisation se produit préférentiellement au niveau de l'atome de carbone le plus encombré adjacent au cation iodonium . Cela est dû au fait que le carbone le plus substitué est mieux à même de maintenir une charge positive partielle et est donc plus électrophile et sensible aux attaques nucléophiles. Lorsque plusieurs doubles liaisons dans une molécule sont également réactives, les préférences conformationnelles dominent. Cependant, lorsqu'une double liaison est plus réactive, cette réactivité domine toujours quelle que soit la préférence conformationnelle.
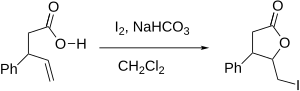
Les deux anneaux à cinq et six chaînons pourraient être formés dans l'iodolactonisation représentée ci-dessous, mais l'anneau à cinq chaînons est formé préférentiellement comme prévu par les règles de Baldwin pour la fermeture de l'anneau. Selon les règles, les fermetures à anneau 5-exo-tét sont favorisées tandis que les fermetures à anneau 6-endo-tét sont défavorisées. La régiosélectivité de chaque iodolactonisation peut être prédite et expliquée à l'aide des règles de Baldwin.
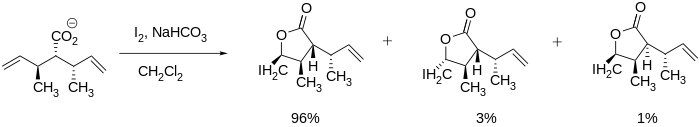
Des iodolactonisations stéréosélectives ont été vues dans la littérature et peuvent être très utiles dans la synthèse de grosses molécules telles que la vernopéline et la vernoménine mentionnées ci-dessus car la lactone peut être formée tout en conservant d'autres stéréocentres. La fermeture de cycle peut même être entraînée par des stéréocentres adjacents à la liaison multiple carbone-carbone comme illustré ci-dessous.
Même dans les systèmes sans stéréocentres existants, Bartlett et ses collègues ont constaté que la stéréosélectivité était réalisable. Ils ont pu synthétiser les lactones à cinq membres cis et trans en ajustant les conditions de réaction telles que la température et le temps de réaction. Le produit trans a été formé dans des conditions thermodynamiques (par exemple un temps de réaction long) tandis que le produit cis a été formé dans des conditions cinétiques (par exemple un temps de réaction relativement plus court).
Applications
L'iodolactonisation a été utilisée dans la synthèse de nombreux produits biologiquement importants tels que les inhibiteurs de croissance tumorale, la vernolépine et la vernoménine, l'inhibiteur de la lipase pancréatique, la vibralactone, et les prostaglandines, un lipide présent chez les animaux. Les synthèses totales suivantes utilisent toutes l'iodolactonisation comme étape clé dans l'obtention du produit souhaité.
En 1977, Samuel Danishefsky et ses collègues ont pu synthétiser les inhibiteurs de croissance tumorale dl -vernolépine et dl -vernoménine via un processus en plusieurs étapes dans lequel une lactonisation a été employée. Cette synthèse démontre l'utilisation de l'iodolactonisation pour former préférentiellement un cycle à cinq chaînons sur un cycle à quatre ou six chaînons, comme prévu d'après les règles de Baldwin.
En 2006, Zhou et ses collègues ont synthétisé un autre produit naturel, la vibralactone, dans lequel l'étape clé était la formation d'une lactone. La stéréosélectivité de l'iodolactonisation établit une configuration stéréochimique critique pour le composé cible.
En 1969, Corey et ses collègues ont synthétisé la prostaglandine E 2 en utilisant un intermédiaire iodolactone. Là encore, la stéréosélectivité de l'iodolactonisation joue un rôle intégral dans la formation du produit.