Thyroïdite de Hashimoto - Hashimoto's thyroiditis
| La thyroïdite d'Hashimoto | |
|---|---|
| Autres noms | Thyroïdite lymphocytaire chronique, thyroïdite auto-immune, struma lymphomatosa, maladie de Hashimoto |
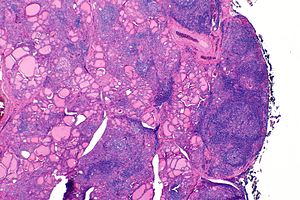 | |
| La thyroïde d'une personne atteinte de la thyroïdite de Hashimoto vue au microscope à faible grossissement | |
| Spécialité | Endocrinologie |
| Symptômes | Indolore goitre , le gain de poids , sensation de fatigue , la constipation , la dépression , la peau sèche , perte de cheveux |
| Complications | Lymphome thyroïdien . |
| Début habituel | 30-50 ans |
| Causes | Facteurs génétiques et environnementaux . |
| Facteurs de risque | Antécédents familiaux, une autre maladie auto-immune |
| Méthode de diagnostic | TSH , T4, auto-anticorps anti-thyroïdiens |
| Diagnostic différentiel | Maladie de Basedow , goitre nodulaire non toxique |
| Traitement | Lévothyroxine , chirurgie |
| La fréquence | 5% à un moment donné |
La thyroïdite de Hashimoto , également connue sous le nom de thyroïdite lymphocytaire chronique et maladie de Hashimoto , est une maladie auto-immune dans laquelle la glande thyroïde est progressivement détruite. Au début, les symptômes peuvent ne pas être remarqués. Au fil du temps, la thyroïde peut grossir, formant un goitre indolore . Certaines personnes finissent par développer une hypothyroïdie avec prise de poids , fatigue , constipation , dépression , perte de cheveux et douleurs générales. Après de nombreuses années, la thyroïde diminue généralement de taille. Les complications potentielles incluent le lymphome thyroïdien .
On pense que la thyroïdite de Hashimoto est due à une combinaison de facteurs génétiques et environnementaux . Les facteurs de risque comprennent des antécédents familiaux de la maladie et une autre maladie auto-immune. Le diagnostic est confirmé par des tests sanguins pour la TSH , la T4 et les auto-anticorps antithyroïdiens . D'autres affections pouvant produire des symptômes similaires incluent la maladie de Graves et le goitre nodulaire non toxique .
La thyroïdite de Hashimoto est généralement traitée avec de la lévothyroxine . Si l'hypothyroïdie n'est pas présente, certains peuvent ne recommander aucun traitement, tandis que d'autres peuvent traiter pour essayer de réduire la taille du goitre. Les personnes concernées doivent éviter de manger de grandes quantités d' iode ; cependant, une quantité suffisante d'iode est nécessaire, en particulier pendant la grossesse. La chirurgie est rarement nécessaire pour traiter le goitre.
La thyroïdite de Hashimoto affecte environ 5% des Caucasiens à un moment donné de leur vie. Elle débute généralement entre 30 et 50 ans et est beaucoup plus fréquente chez les femmes que chez les hommes. Les taux de la maladie semblent augmenter. Il a été décrit pour la première fois par le médecin japonais Hakaru Hashimoto en 1912. En 1957, il a été reconnu comme une maladie auto-immune.
Signes et symptômes
De nombreux symptômes sont attribués au développement de la thyroïdite de Hashimoto. Les symptômes les plus courants incluent : fatigue , prise de poids, visage pâle ou bouffi, sensation de froid, douleurs articulaires et musculaires , constipation , cheveux secs et clairsemés, flux menstruel abondant ou règles irrégulières , dépression , trouble panique , ralentissement du rythme cardiaque et problèmes tomber enceinte et maintenir sa grossesse.
La maladie de Hashimoto est environ sept fois plus fréquente chez les femmes que chez les hommes. Elle peut survenir chez les adolescentes et les jeunes femmes, mais apparaît plus fréquemment à l'âge mûr, en particulier chez les hommes. Les personnes qui développent la maladie de Hashimoto ont souvent des membres de leur famille qui souffrent de maladies thyroïdiennes ou d'autres maladies auto-immunes, et parfois elles-mêmes d'autres maladies auto-immunes.
La glande thyroïde peut devenir ferme, volumineuse et lobulée dans la thyroïdite de Hashimoto, mais les modifications de la thyroïde peuvent également être non palpables. L' hypertrophie de la thyroïde est due à une infiltration lymphocytaire et à une fibrose plutôt qu'à une hypertrophie tissulaire . Si leur rôle dans la destruction initiale des follicules n'est pas clair, les anticorps contre la peroxydase thyroïdienne ou la thyroglobuline sont pertinents, car ils servent de marqueurs pour détecter la maladie et sa gravité. On pense qu'ils sont les produits secondaires de la destruction de la glande par les cellules T.
Il se caractérise également par l' invasion du tissu thyroïdien par les leucocytes , principalement des lymphocytes T . Une complication rare mais grave est le lymphome thyroïdien , généralement de type B, lymphome non hodgkinien .
Facteurs de risque
La forte composante génétique est confirmée par des études sur des jumeaux monozygotes, avec une concordance de 38 à 55 %, avec une concordance encore plus élevée des anticorps thyroïdiens circulants sans rapport avec la présentation clinique (jusqu'à 80 % chez les jumeaux monozygotes). Aucun résultat n'a été observé à un degré similaire chez les jumeaux dizygotes, offrant une forte faveur pour une étiologie génétique élevée.
Médicaments qui influencent la fonction thyroïdienne
Certains médicaments ou médicaments ont été associés à une altération et à une interférence avec la fonction thyroïdienne. Parmi ces médicaments, il existe deux principaux mécanismes d'interférence qu'ils peuvent avoir.
L'un des mécanismes d'interférence est lorsqu'un médicament altère les protéines de transfert sériques des hormones thyroïdiennes. L'œstrogène, le tamoxifène, l'héroïne, la méthadone, le clofibrate, le 5-fluorouracile, le mitotane et la perphénazine augmentent tous la concentration de la globuline liant la thyroïde (TBG). Les androgènes, les stéroïdes anabolisants tels que le danazol , les glucocorticoïdes et l'acide nicotinique à libération lente diminuent tous les concentrations de TBG. Le furosémide, le fénofenac, l'acide méfénamique, les salicylates, la phénytoïne, le diazépam, les sulfamides hypoglycémiants, les acides gras libres et l'héparine interfèrent tous avec la liaison de l'hormone thyroïdienne à la TBG et/ou à la transthyrétine .
L'autre mécanisme que les médicaments peuvent utiliser pour interférer avec la fonction thyroïdienne serait de modifier le métabolisme extra-thyroïdien de l'hormone thyroïdienne. Le propylthiouracile, les glucocorticoïdes, le propanolol, les agents de contraste ionisés, l'amiodarone et la clomipramine inhibent tous la conversion de T4 et T3. Le phénobarbital, la rifampine, la phénytoïne et la carbamazépine augmentent tous le métabolisme hépatique. Enfin, la cholestryamine, le colestipol, l'hydroxyde d'aluminium, le sulfate ferreux et le sucralfate sont tous des médicaments qui diminuent l'absorption de la T4 ou améliorent l'excrétion.
Gènes HLA
Le premier locus génique associé à la maladie thyroïdienne auto-immune était la région du complexe majeur d'histocompatibilité (CMH) sur le chromosome 6p21. Il encode les HLA. Les allèles HLA spécifiques ont une affinité plus élevée pour les peptides thyroïdiens auto-antigéniques et peuvent contribuer au développement d'une maladie thyroïdienne auto-immune. Spécifiquement, dans la maladie de Hashimoto, une expression aberrante de HLA II sur les thyrocytes a été démontrée. Ils peuvent présenter des auto-antigènes thyroïdiens et déclencher une maladie thyroïdienne auto-immune. Les allèles de sensibilité ne sont pas cohérents dans la maladie de Hashimoto. Chez les Caucasiens, divers allèles seraient associés à la maladie, notamment DR3, DR5 et DQ7.
Gènes CTLA-4
Ce gène est le deuxième gène de régulation immunitaire majeur lié à la maladie thyroïdienne auto-immune. Les polymorphismes du gène CTLA-4 peuvent contribuer à l'inhibition réduite de la prolifération des lymphocytes T et augmenter la susceptibilité à la réponse auto-immune. CTLA-4 est un gène majeur de susceptibilité aux auto-anticorps thyroïdiens. Une liaison de la région CTLA-4 à la présence d'auto-anticorps thyroïdiens a été démontrée par une analyse de liaison du génome entier. CTLA-4 a été confirmé comme le locus principal des auto-anticorps thyroïdiens.
Gène de type 22 non récepteur de la protéine tyrosine phosphatase
PTPN22 est le gène de régulation immunitaire le plus récemment identifié associé à une maladie thyroïdienne auto-immune. Il est localisé sur le chromosome 1p13 et exprimé dans les lymphocytes. Il agit comme un régulateur négatif de l'activation des lymphocytes T. La mutation de ce gène est un facteur de risque pour de nombreuses maladies auto-immunes. Une signalisation plus faible des cellules T peut entraîner une altération de la suppression thymique des cellules T autoréactives, et une fonction accrue de PTPN22 peut entraîner une inhibition des cellules T régulatrices, qui protègent contre l'auto-immunité.
L'IFN-γ favorise la cytotoxicité à médiation cellulaire contre la thyroïde. Des mutations provoquant une augmentation de la production d'IFN-γ étaient associées à la gravité de l'hypothyroïdie. L'hypothyroïdie sévère est associée à des mutations entraînant une diminution de la production d'IL-4 (auto-immunité à médiation cellulaire supprimant les cytokines Th2), une diminution de la sécrétion de TGF-β (inhibiteur de la production de cytokines) et des mutations de FoxP3, un facteur régulateur essentiel pour le développement des Tregs. . Le développement de la maladie de Hashimoto a été associé à une mutation du gène du TNF-α (stimulateur de la production d'IFN-γ), provoquant sa concentration plus élevée.
Des facteurs environnementaux évitables, notamment un apport élevé en iode, une carence en sélénium , des maladies infectieuses et certains médicaments, ont été impliqués dans le développement de maladies thyroïdiennes auto-immunes chez des individus génétiquement prédisposés.
Iode
Un apport excessif en iode est un facteur environnemental bien établi pour déclencher l'auto-immunité thyroïdienne. Une prévalence plus élevée d'auto-anticorps thyroïdiens est observée dans les zones où l'apport en iode est plus élevé. Plusieurs mécanismes par lesquels l'iode peut favoriser l'auto-immunité thyroïdienne ont été proposés. L'exposition à l'iode entraîne une iodation plus élevée de la thyroglobuline, augmentant son immunogénicité en créant de nouveaux épitopes contenant de l'iode ou en exposant des épitopes cryptiques. Il peut faciliter la présentation par APC, améliorer l'affinité de liaison du récepteur des cellules T et activer des cellules T spécifiques.
Il a été démontré que l'exposition à l'iode augmente le niveau d'espèces réactives de l'oxygène. Ils améliorent l'expression de la molécule d'adhésion intracellulaire-1 sur les cellules folliculaires thyroïdiennes, ce qui pourrait attirer les cellules immunocompétentes dans la glande thyroïde.
L'iode est toxique pour les thyrocytes car des espèces oxygénées hautement réactives peuvent se lier aux lipides et aux protéines membranaires. Il provoque des dommages thyroïdiens et la libération d'auto-antigènes. L'iode favorise également l'apoptose des cellules folliculaires et a une influence sur les cellules immunitaires (maturation augmentée des cellules dendritiques, augmentation du nombre de cellules T, production d'immunoglobulines B stimulée).
Les données de l'enquête danoise sur l'apport d'iode et les maladies de la thyroïde montrent que dans deux cohortes (hommes, femmes) présentant une carence en iode modérée et légère, les taux d'anticorps anti-peroxydase thyroïdienne et thyroglobuline sont plus élevés chez les femmes, et les taux de prévalence des deux anticorps augmentent avec âge.
Genre
Une étude de jumeaux danois en bonne santé répartis en trois groupes (monozygotes et dizygotes du même sexe et paires de jumeaux de sexe opposé) a estimé que la contribution génétique à la sensibilité aux anticorps anti-thyroïdie peroxydase était de 61 % chez les hommes et de 72 % chez les femmes, et la contribution à la sensibilité aux anticorps anti-thyroglobuline était de 39 %. % chez les hommes et 75 % chez les femmes.
La forte prédominance féminine dans l'auto-immunité thyroïdienne peut être associée au chromosome X. Il contient des gènes liés au sexe et au système immunitaire responsables de la tolérance immunitaire. Une incidence plus élevée d'auto-immunité thyroïdienne a été rapportée chez les patients présentant un taux plus élevé de monosomie du chromosome X dans les globules blancs périphériques.
Un autre mécanisme potentiel pourrait être une inactivation asymétrique du chromosome X, conduisant à l'échappement des auto-antigènes liés à l'X de la présentation dans le thymus et à la perte de la tolérance des lymphocytes T.
Avoir d'autres maladies auto-immunes est un facteur de risque de développer la thyroïdite de Hashimoto, et l'inverse est également vrai. Les maladies auto-immunes les plus fréquemment associées à la thyroïdite de Hashimoto comprennent la maladie cœliaque , le diabète de type 1 , le vitiligo et l' alopécie .
Les gènes impliqués varient selon les groupes ethniques et l'incidence est augmentée chez les personnes atteintes de troubles chromosomiques, y compris les syndromes de Turner , Down et Klinefelter généralement associés à des auto-anticorps contre la thyroglobuline et la thyroperoxydase . L'épuisement progressif de ces cellules au fur et à mesure que la réponse immunitaire cytotoxique conduit à des degrés plus élevés d'hypothyroïdie primaire, se manifestant par de faibles taux de T3/T4 et des élévations compensatoires de la TSH.
Physiopathologie
De multiples mécanismes par lesquels la pathologie de la thyroïdite de Hashimoto se développe ont été suggérés.
Divers auto-anticorps peuvent être présents contre les récepteurs de la peroxydase thyroïdienne , de la thyroglobuline et de la TSH , bien qu'un petit pourcentage de personnes puisse ne présenter aucun de ces anticorps. Comme indiqué dans diverses études de jumeaux, un pourcentage de la population peut également avoir ces anticorps sans développer la thyroïdite de Hashimoto. Néanmoins, la cytotoxicité à médiation cellulaire dépendante des anticorps est un facteur important derrière les retombées apoptotiques de la thyroïdite de Hashimoto. L'activation des lymphocytes T cytotoxiques ( cellules CD8 + T) en réponse à la réponse immunitaire à médiation cellulaire affectée par les lymphocytes T auxiliaires ( cellules CD4 + T) est au cœur de la destruction des thyroïdes. Comme cela est caractéristique des hypersensibilités de type IV , le recrutement de macrophages est un autre effet de l'activation des lymphocytes T auxiliaires, les lymphocytes de l'axe Th1 produisant des cytokines inflammatoires dans le tissu thyroïdien pour favoriser l'activation des macrophages et la migration dans la glande thyroïde pour un effet direct.
Des changements morphologiques bruts au sein de la thyroïde sont observés dans l'élargissement général, qui est beaucoup plus localement nodulaire et irrégulier que des modèles plus diffus (comme celui de l' hyperthyroïdie ). Alors que la capsule est intacte et que la glande elle-même est toujours distincte du tissu environnant, l'examen microscopique peut fournir une indication plus révélatrice du niveau de dommage.
Histologiquement, l'hypersensibilité est vue comme une infiltration parenchymateuse diffuse par les lymphocytes, en particulier les cellules B plasmatiques , qui peuvent souvent être vues comme des follicules lymphoïdes secondaires (centres germinaux, à ne pas confondre avec les follicules colloïdaux normalement présents qui constituent la thyroïde). L'atrophie des corps colloïdes est tapissée de cellules de Hürthle , des cellules au cytoplasme granulaire intensément éosinophile , une métaplasie des cellules cubiques normales qui constituent la muqueuse des follicules thyroïdiens. L'atrophie thyroïdienne sévère se présente souvent avec des bandes fibreuses de collagène plus denses qui restent dans les limites de la capsule thyroïdienne.
Diagnostic
Le diagnostic est généralement posé en détectant des taux élevés d'anticorps antithyroïdiens peroxydase dans le sérum, mais une thyroïdite séronégative (sans auto-anticorps circulants) est également possible.
Compte tenu du nombre relativement symptômes non spécifiques de l' hypothyroïdie initiale, la thyroïdite de Hashimoto est souvent diagnostiquée à tort comme la dépression , la cyclothymie , le syndrome prémenstruel , le syndrome de fatigue chronique , la fibromyalgie , et moins fréquemment, comme la dysfonction érectile ou d' un trouble anxieux . A l'examen macroscopique, un goitre dur qui n'est pas douloureux au toucher se présente souvent ; d' autres symptômes observés avec l' hypothyroïdie, comme périorbitaire myxoedème , dépendent de l'état actuel de la progression de la réponse, en particulier compte tenu du développement en général progressive de l' hypothyroïdie cliniquement pertinente. La recherche de la thyréostimuline (TSH), de la T3 libre, de la T4 libre et des anticorps antithyroglobuline (anti-Tg), des anticorps anti-peroxydase thyroïdienne (anti-TPO ou TPOAb) et des anticorps antimicrosomaux peut aider à obtenir un diagnostic précis. Une évaluation plus précoce de la personne peut présenter des taux élevés de thyroglobuline en raison d'une thyrotoxicose transitoire , car l'inflammation de la thyroïde endommage l'intégrité du stockage de la thyroglobuline dans les follicules thyroïdiens ; La sécrétion de TSH par l'hypophyse antérieure augmente en réponse à une diminution de la rétroinhibition négative secondaire à une diminution des hormones thyroïdiennes sériques. Typiquement, T4 est le test d'hormone thyroïdienne préféré pour l'hypothyroïdie. On pense que cette exposition du corps à des quantités substantielles d'enzymes thyroïdiennes précédemment isolées contribue à l'exacerbation de la dégradation de la tolérance, provoquant les symptômes plus prononcés observés plus tard dans la maladie. Infiltration lymphocytaire des thyrocyte tissus -Associated souvent conduit à la découverte histologiquement importante du centre germinatif développement au sein de la glande thyroïde.
Le syndrome de Hashimoto lorsqu'il se présente comme une manie est connu sous le nom de syndrome de Prasad d'après Ashok Prasad, le psychiatre qui l'a décrit le premier.
Traitement
Gérer les niveaux d'hormones
L'hypothyroïdie causée par la thyroïdite de Hashimoto est traitée avec des agents de remplacement des hormones thyroïdiennes tels que la lévothyroxine , la triiodothyronine ou l' extrait thyroïdien desséché . Un comprimé pris une fois par jour maintient généralement les niveaux d'hormones thyroïdiennes normaux. Dans la plupart des cas, le traitement doit être pris pour le reste de la vie de la personne. Si l'hypothyroïdie est causée par la thyroïdite de Hashimoto, il peut être recommandé de maintenir les taux de TSH inférieurs à 3,0 m UI /l.
Pronostic
Un dysfonctionnement thyroïdien manifeste et symptomatique est la complication la plus courante, avec environ 5 % des personnes atteintes d'hypothyroïdie infraclinique et de thyroïdite auto-immune chronique évoluant chaque année vers une insuffisance thyroïdienne. Des périodes transitoires de thyréotoxicose (hyperactivité de la thyroïde) surviennent parfois, et rarement la maladie peut évoluer vers une hyperthyroïdie complète Maladie de Basedow avec orbitopathie active (yeux bombés, enflammés). De rares cas de thyroïdite auto-immune fibreuse se présentent avec un essoufflement sévère et des difficultés à avaler , ressemblant à des tumeurs thyroïdiennes agressives, mais ces symptômes s'améliorent toujours avec la chirurgie ou la corticothérapie. Le lymphome primitif à cellules B de la thyroïde affecte moins d'une personne sur 1000, et il est plus susceptible d'affecter les personnes atteintes de thyroïdite auto-immune de longue date.
Épidémiologie
Ce trouble est considéré comme la cause la plus fréquente d'hypothyroïdie primaire en Amérique du Nord; en tant que cause de goitre non endémique, il est parmi les plus courants. La thyroïdite de Hashimoto affecte environ 5% des Caucasiens à un moment donné de leur vie. Aux États-Unis, elle affecte moins d'Afro-américains, mais est liée à une mortalité plus élevée dans la population afro-américaine. Il est également moins fréquent dans les populations asiatiques. Environ 1,0 à 1,5 sur 1000 personnes ont cette maladie à tout moment. Elle survient entre huit et 15 fois plus souvent chez les femmes que chez les hommes. Bien qu'elle puisse survenir à tout âge, y compris chez l'enfant, elle est le plus souvent observée chez les femmes entre 30 et 60 ans. Certaines recherches suggèrent un lien avec le rôle du placenta comme explication de la différence entre les sexes.
Il est plus fréquent dans les régions à forte consommation d'iode et chez les personnes génétiquement sensibles.
Histoire
Également connue sous le nom de maladie de Hashimoto, la thyroïdite de Hashimoto doit son nom au médecin japonais Hakaru Hashimoto (1881−1934) de la faculté de médecine de l'université de Kyushu , qui a décrit pour la première fois les symptômes des personnes atteintes de struma lymphomatosa , une infiltration intense de lymphocytes dans la thyroïde, en 1912. dans le journal allemand Archiv für Klinische Chirurgie . Cet article était composé de 30 pages et de 5 illustrations décrivant toutes les modifications histologiques du tissu thyroïdien. De plus, tous les résultats de sa première étude ont été recueillis auprès de quatre femmes. Ces résultats expliquent les caractéristiques pathologiques observées chez ces femmes en particulier l'infiltration de cellules lymphoïdes et plasmatiques ainsi que la formation de follicules lymphoïdes avec des centres germinatifs, une fibrose, des cellules épithéliales thyroïdiennes dégénérées et des leucocytes dans la lumière. Il a décrit ces traits comme étant histologiquement similaires à ceux de la maladie de Mikulic. Comme mentionné ci-dessus, une fois qu'il a découvert ces traits dans cette nouvelle maladie, il nomme la maladie struma lymphomatosa. Cette maladie mettait l'accent sur l'infiltration des cellules lymphoïdes et la formation des follicules lymphoïdes avec des centres germinatifs, ce qui n'avait jamais été signalé auparavant.
Malgré la découverte et la publication du Dr Hashimoto, la maladie n'a malheureusement pas été reconnue comme distincte de la thyroïdite de Reidel qui était une maladie courante à cette époque en Europe. Bien que de nombreux autres articles aient été rapportés et publiés par d'autres chercheurs, le struma lymphomatosa de Hashimoto n'a été reconnu comme une phase précoce de la thyroïdite de Reidel qu'au début des années 1900. Ce n'est qu'en 1931 que la maladie a été reconnue comme une maladie à part entière lorsque les chercheurs Allen Graham et al de Cleveland ont rapporté ses symptômes et sa présentation de la même manière détaillée que Hakuru.
En 1956, les Drs Rose et Witebsky ont pu démontrer comment l'immunisation de certains rongeurs avec des extraits de la thyroïde d'autres rongeurs ressemblait à la maladie que Hakuru et d'autres chercheurs essayaient de décrire. Ces médecins ont également pu décrire des anticorps anti-thyroglobuline dans des échantillons de sérum sanguin de ces mêmes animaux.
Plus tard dans la même année, des chercheurs du Middlesex Hospital de Londres ont pu effectuer des expériences humaines sur des patients présentant des symptômes similaires. Ils ont purifié les anticorps anti-thyroglobuline de leur sérum et ont pu conclure que ces patients malades ont une réaction immunologique à la thyroglobuline humaine. À partir de ces données, il a été proposé que le struma de Hashimoto pourrait être une maladie auto-immune de la glande thyroïde.
En 1957, elle a été reconnue comme une maladie auto-immune et a été la première maladie auto-immune spécifique à un organe identifiée.
Suite à cette reconnaissance, les mêmes chercheurs du Middlesex Hospital ont publié en 1962 un article dans Lancet qui a fini par inclure un portrait de Hakuru Hashimoto. La maladie a pu devenir beaucoup plus connue à partir de ce moment et la maladie de Hashimoto est devenue plus fréquente dans les manuels.
Depuis ces découvertes, un certain nombre de maladies auto-immunes ont pu être découvertes, plusieurs d'entre elles étant liées à des anticorps spécifiques de la thyroïde.
Grossesse
Les femmes enceintes qui sont positives pour la thyroïdite de Hashimoto peuvent avoir une fonction thyroïdienne diminuée ou la glande peut échouer complètement. Si une femme est positive au TPOAb, les cliniciens peuvent l'informer des risques pour elle-même et son nourrisson si la maladie n'est pas traitée. "Les anticorps anti-peroxydase thyroïdienne (TPOAb) sont détectés chez 10% des femmes enceintes", ce qui présente des risques pour ces grossesses. Les femmes dont la fonction thyroïdienne n'a pas été stabilisée courent un plus grand risque d'avoir un enfant avec : un faible poids à la naissance, une détresse respiratoire néonatale, une hydrocéphalie , un hypospadias , une fausse couche et un accouchement prématuré. Le taux de transplantation d'embryons et les résultats de grossesse réussis sont améliorés lorsque Hashimoto est traité. Les recommandations sont de ne traiter les femmes enceintes que si elles sont positives pour les anticorps anti-TPO pendant toute la durée de leur grossesse et de dépister toutes les femmes enceintes pour les niveaux de thyroïde. Une coopération étroite entre l'endocrinologue et l'obstétricien profite à la femme et au nourrisson. L'Endocrine Society recommande le dépistage chez les femmes enceintes considérées à haut risque de maladie auto-immune de la thyroïde.
Le test des anticorps anti-peroxydes thyroïdiens est recommandé pour les femmes qui ont déjà été enceintes, quelle que soit l'issue de la grossesse. "... Les grossesses antérieures jouent un rôle majeur dans le développement de l'hypothyroïdie auto-immune manifeste chez les femmes préménopausées, et le nombre de grossesses antérieures doit être pris en compte lors de l'évaluation du risque d'hypothyroïdie chez une jeune femme [ sic ]. "
Les changements hormonaux et l'expression des trophoblastes de molécules immunomodulatrices clés entraînent une immunosuppression et une tolérance fœtale. Les principaux acteurs de la régulation de la réponse immunitaire sont les Tregs. Les réponses immunitaires à médiation cellulaire et humorale sont atténuées, entraînant une tolérance immunitaire et une suppression de l'auto-immunité. Il a été rapporté que pendant la grossesse, les taux de peroxydase thyroïdienne et d'anticorps anti-thyroglobuline diminuent. Après l'accouchement, les Tregs diminuent rapidement et les réponses immunitaires se rétablissent. Elle peut entraîner la survenue ou l'aggravation de la maladie thyroïdienne auto-immune. Chez jusqu'à 50 % des femmes présentant des anticorps anti-peroxydase thyroïdienne au début de la grossesse, l'auto-immunité thyroïdienne pendant la période post-partum s'exacerbe sous la forme d'une thyroïdite post-partum. Une sécrétion plus élevée d'IFN-γ et d'IL-4 et une concentration plasmatique de cortisol plus faible pendant la grossesse ont été rapportées chez les femmes atteintes de thyroïdite post-partum que chez les femmes en bonne santé. Cela indique qu'une immunosuppression plus faible pendant la grossesse pourrait contribuer au dysfonctionnement thyroïdien post-partum.
Microchimérisme fœtal
Plusieurs années après l'accouchement, les cellules mâles chimériques peuvent être détectées dans le sang périphérique maternel, la thyroïde, les poumons, la peau ou les ganglions lymphatiques. Les cellules immunitaires fœtales de la glande thyroïde maternelle peuvent s'activer et agir comme un déclencheur qui peut initier ou exagérer la maladie thyroïdienne auto-immune. Chez les patients atteints de la maladie de Hashimoto, des cellules microchimériques fœtales ont été détectées dans la thyroïde en nombre significativement plus élevé que chez les femmes en bonne santé.
Voir également
Les références
| Classification | |
|---|---|
| Ressources externes |

