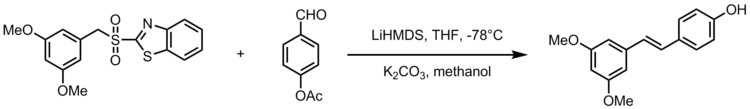Oléfination de Julia - Julia olefination
| Oléfination de Julia | |
|---|---|
| Nommé après | Marc Julia |
| Type de réaction | Réaction de couplage |
| Identifiants | |
| Portail de la chimie organique | julia-oléfination |
| ID d'ontologie RSC | RXNO: 0000117 |
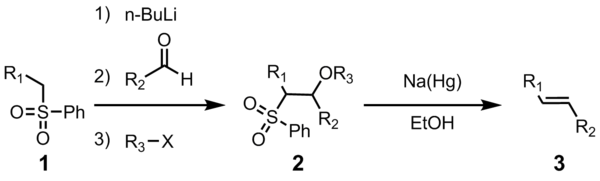
Le Julia oléfination (également connu sous le nom Julia-Lythgoe oléfination) est la réaction chimique utilisé dans la chimie organique de phényle sulfones (1) avec des aldéhydes (ou cétones ) pour donner des alcènes (oléfines) (3) après la fonctionnalisation de l' alcool et l' élimination réductrice en utilisant sodium amalgame ou SmI 2 . La réaction porte le nom du chimiste français Marc Julia .
L'utilité de cette réaction d'oléfination conjonctive provient de sa polyvalence, de sa large tolérance au groupe fonctionnel et des conditions de réaction douces dans lesquelles la réaction se déroule.
Les quatre étapes peuvent être effectuées dans un seul récipient de réaction, et l' utilisation de R 3 X est facultatif. Cependant, la purification de l'intermédiaire sulfone 2 conduit à un rendement et une pureté plus élevés. Le plus souvent, R 3 est acétyle ou benzoyle , avec de l'anhydride acétique ou du chlorure de benzoyle utilisé dans la préparation de 2.
Histoire
En 1973, Marc Julia et Jean-Marc Paris ont rapporté une nouvelle synthèse d'oléfine dans laquelle les β-acyloxysulfones ont été éliminées par réduction en les alcènes di-, tri- ou tétrasubstitués correspondants. Basil Lythgoe et Philip J. Kocienski ont exploré la portée et la limitation de la réaction, et aujourd'hui cette oléfine est officiellement connue sous le nom d'oléfination de Julia-Lythgoe. La réaction implique l'addition d'un carbanion stabilisé par un sulfonyle à un composé carbonyle, suivie d'une élimination pour former un alcène. Dans les versions initiales des réactions, l'élimination se faisait dans des conditions réductrices. Plus récemment, une version modifiée qui évite cette étape a été développée. La première version est parfois appelée oléfination de Julia-Lythgoe, tandis que la seconde est appelée oléfination de Julia-Kocienski. Dans la variante réductrice, l'adduit est généralement acylé puis traité avec un agent réducteur, tel que l'amalgame de sodium ou SmI 2 . Plusieurs revues de ces réactions ont été publiées.
Mécanisme de réaction
Les étapes initiales sont simples. L' anion phénylsulfone (2) réagit avec un aldéhyde pour former l' alcoolate (3). L'alcoxyde est fonctionnalisé avec R 3 -X pour donner l'intermédiaire stable (4). Le mécanisme exact de la réduction de l'amalgame de sodium est inconnu, mais il a été démontré qu'il passe par une espèce de radical vinylique (5). La protonation du radical vinylique donne le produit souhaité (6).
La stéréochimie de l'alcène (6) est indépendante de la stéréochimie de l'intermédiaire sulfone 4. On pense que les intermédiaires radicaux sont capables de s'équilibrer de sorte que la trans-oléfine thermodynamiquement plus stable est produite le plus souvent. Cette transformation favorise fortement la formation du E- alcène.
Variations
Oléfination de Julia modifiée
L'oléfination de Julia modifiée, également connue sous le nom d'oléfination de Julia en un seul pot, est une modification de l'oléfination de Julia classique. Le remplacement des phénylsulfones par des hétéroarylsulfones modifie considérablement la voie de réaction. L'exemple le plus populaire est la benzothiazole sulfone. La réaction de la benzothiazole sulfone (1) avec le diisopropylamide de lithium (LDA) donne une benzothiazolyl sulfone métallisée, qui réagit rapidement avec les aldéhydes (ou cétones) pour donner un intermédiaire alcoxyde (2). Contrairement aux phénylsulfones, cet intermédiaire alcoolate (2) est plus réactif et subira un réarrangement Smiles pour donner le sel sulfinate (4). Le sel sulfinate (4) éliminera spontanément le dioxyde de soufre et la benzothiazolone de lithium (5) produisant l'alcène souhaité (6).
Puisque la variation de benzothiazole de l'oléfination de Julia n'implique pas d'intermédiaires d'équilibrage, le résultat stéréochimique est le résultat de la stéréochimie de l'addition initiale de carbonyle. En conséquence, cette réaction génère souvent un mélange de stéréoisomères d'alcène.
Oléfination de Julia – Kocienski
| Oléfination de Julia – Kocienski | |
|---|---|
| Nommé après |
Marc Julia Philip Joseph Kocienski |
| Type de réaction | Réaction de couplage |
| Identifiants | |
| Portail de la chimie organique | oléfination-julia-kocienski-modifiée |
| ID d'ontologie RSC | RXNO: 0000304 |
L'oléfination de Julia-Kocienski, un raffinement supplémentaire de l'oléfination de Julia modifiée, offre une très bonne E- sélectivité. Dans l'oléfination de Julia – Kocienski, l' agent alkylant est un tétrazole . Il procède avec le même mécanisme que la benzothiazole sulfone ci-dessus. La haute E -sélectivité de l'oléfination de Julia – Kocienski est le résultat de l'addition diastéréosélective cinétiquement contrôlée de sulfones de 1-phényl-1H-tétrazol-5-yle (PT) métallisés à des aldéhydes non conjugués. Cela donne des anti-ß-alcoxysulfones qui se décomposent de manière stéréospécifique en E- alcènes. Dans une adaptation, avec la t-butyltétrazoylméthylsulfone, les conditions de réaction sont soit du bis (triméthylsilyl) amide de sodium à -70 ° C dans du tétrahydrofurane, soit du carbonate de césium à +70 ° C. Cette réaction porte le nom de Philip J. Kocienski pour sa modification de l'oléfination de Julia.
Applications synthétiques
La réaction d'oléfination de Julia ou Julia modifiée est une transformation synthétique puissante et polyvalente, largement utilisée dans la construction de produits naturels complexes avec un excellent contrôle de l'isomérie géométrique.
Ptérostilbène
Le ptérostilbène est un stilbénoïde chimiquement lié au resvératrol. Il appartient au groupe des phytoalexines, agents produits par les plantes pour lutter contre les infections. Le ptérostilbène est un analogue naturel de l'éther diméthylique du resvératrol. On pense que le composé a également des propriétés anti-diabétiques , mais jusqu'à présent, très peu d'études ont été effectuées sur cette question.
Par rapport aux réactions de Wittig , Wittig-Horner, Perkin ou catalysées par un métal de transition pour synthétiser le ptérostilebène, l'oléfination de Julia offre une méthode alternative simple et économique pour la préparation du ptérostilbène.
Resvératrol
Une adaptation de l'oléfination de Julia-Kocienski donne la synthèse du resvératrol stilbénoïde , un composé naturel présent dans les aliments courants comme les raisins, les vins et les noix. Le resvératrol est un stilbénoïde biologiquement important qui aurait de nombreux avantages pour la santé. L'oléfination de Julia-Kocienski sert de réaction puissante dans la synthèse d'analogues de resvératrol avec des 3,5-bis (trifluorométhyl) phényl sulfones. Le schéma suivant affiche le schéma général de synthèse des analogues du resvératrol, où R 2 est un groupe aryle.
(-) - Callystatine A
Dans la synthèse totale asymétrique de (-) - callystatine A par Amos Smith , deux oléfinations de Julia séparées ont été utilisées pour ajouter deux fragments E- alcène. (-) - la callystatine A fait partie de la famille des antibiotiques de la leptomycine. Le schéma suivant montre l'oléfination de Julia-Kocienski utilisée pour obtenir le précurseur du produit naturel, comme indiqué par l'utilisation de la PT-sulfone.
Voir également
- Réaction de Horner – Wadsworth – Emmons
- Réaction de Johnson – Corey – Chaykovsky
- Oléfination de Peterson
- Réaction de Wittig
Les références
- ^ Julia, M.; Paris, J.-M. Tetrahedron Lett. 1973,14, 4833-4836. (doi:10.1016 / S0040-4039 (01) 87348-2)
- ^ Kocienski, PJ; Lythgoe, B .; Ruston, S. J. Chem. Soc., Perkin Trans. 1 1978, 829.
- ^ Keck, GE; Savin, KA; Weglarz, MA J. Org. Chem. 1995,60, 3194–3204. (doi:10.1021 / jo00115a041)
- ^ Kocienski, PJPhosphorus et Sulphur1985,24, 97–127. (La revue)
- ^ Kelly, SESynthèse Organique Complète1991,1, 792–806. (Révision) (doi:10.1016 / B978-0-08-052349-1.00020-2)
- ^ Blakemore, PR J. Chem. Soc., Perkin Trans. 1 2002, 2563–2585. (doi:10.1039 / b208078h)
- ^ Baudin, JB; Hareau, G .; Julia, SA; Ruel, O. Tetrahedron Lett. 1991,32, 1175. (doi:10.1016 / S0040-4039 (00) 92037-9)
- ^ Trêve, NOUS; Kreider, EM; Marque, WW Org. Réagir. 1970,18, 99. (Critique)
- ^ Paul R. Blakemore, William J. Cole, Philip J. Kocieński, Andrew Morley Synlett 1998, 26-28. (doi:10.1055 / s-1998-1570)
- ^ Christophe Aïssa J. Org. Chem. 2006,71, 360–63. (doi:10.1021 / jo051693a)
- ^ Zajc, B. et Kumar, R. (2010). Synthèse des fluorooléfines via l'oléfination de Julia-Kocienski. Synthesis, 2010 (11), 1822–1836. (Doi:10.1055 / s-0029-1218789)
- ^ Langcake, P .; Pryce, RJ (1977). "Une nouvelle classe de phytoalexines de vignes". Experientia33 (2): 151–2. (doi:10.1007 / BF02124034) PMID 844529.
- ^ Moro, AV; Cardoso, FSP; Correia, CRD Heck arylation des styrènes avec des sels d'arènediazonium: synthèse courte, efficace et stéréosélective du resvératrol, DMU-212 et analogues. Tetrahedron Lett. 2008, 49 (39), 5668-5671.
- ^ Prabhakar Peddikotla, Amar G. Chittiboyina, Ikhlas A. Khan, (2014) ChemInform Résumé: Synthèse du ptérostilbène par Julia Olefination. ChemInform 45,doi:10.1002 / chin.201408101.
- ^ Alonso DA, Fuensanta M, Nájera C, Varea M.J. Org. Chem. 2005; 70: 6404–6416. PMID 16050703.
- ^ AB Smith, III et BM Brandt. Synthèse totale de (-) - Callystatine A.Org. Lett. 2001, 3, 1685-1688.
- ^ Robiette, R .; Pospíšil, J. Sur l'origine de la sélectivité E / Z dans l'oléfination de Julia modifiée: importance de l'étape d'élimination; EUR. J. Org. Chem. 2013, 836-840.