Méthode Kjeldahl - Kjeldahl method
La méthode Kjeldahl ou digestion Kjeldahl ( prononciation danoise : [ˈkʰelˌtɛˀl] ) en chimie analytique est une méthode de détermination quantitative de l' azote contenu dans les substances organiques plus l'azote contenu dans les composés inorganiques ammoniac et ammonium (NH 3 /NH 4 + ). Sans modification, d'autres formes d'azote inorganique, par exemple le nitrate , ne sont pas incluses dans cette mesure. En utilisant une relation empirique entre la teneur en azote Kjeldahl et la teneur en protéines, c'est une méthode importante pour analyser les protéines. Cette méthode a été développée par Johan Kjeldahl en 1883.
Méthode
La méthode consiste à chauffer un échantillon à 360-410 °C avec de l'acide sulfurique concentré (H 2 SO 4 ), qui décompose (« digère » ou « détruit ») l'échantillon organique par oxydation pour libérer l'azote réduit sous forme de sulfate d'ammonium . L'acide sulfurique concentré chaud oxyde le carbone (comme le charbon bitumineux) et le soufre (voir les réactions de l'acide sulfurique avec le carbone ):
- C + 2 H 2 SO 4 → CO 2 + 2 SO 2 + 2 H 2 O
- S + 2 H 2 SO 4 → 3 SO 2 + 2 H 2 O
Des catalyseurs comme le sélénium , Hg 2 SO 4 ou CuSO 4 sont souvent ajoutés pour accélérer la digestion. Na 2 SO 4 ou K 2 SO 4 est également ajouté pour augmenter le point d'ébullition de H 2 SO 4 . La digestion est terminée lorsque la liqueur se clarifie avec dégagement de fumées. Un système de distillation décrit ci-dessous est construit.
 |
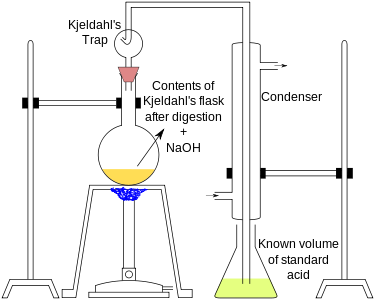
|
L'extrémité du condenseur est plongée dans un volume connu d'acide standard (c'est-à-dire d'acide de concentration connue). Un acide faible comme l'acide borique (H 3 BO 3 ) en excès d'ammoniac est souvent utilisé. HCl standardisé , H 2 SO 4 ou un autre acide fort peut être utilisé à la place, mais c'est moins courant. La solution échantillon est ensuite distillée avec une petite quantité d' hydroxyde de sodium (NaOH). NaOH peut également être ajouté avec un entonnoir compte-gouttes . NaOH fait réagir l' ammonium (NH 4 + ) en ammoniac (NH 3 ), ce qui fait bouillir la solution échantillon. L'ammoniac bouillonne à travers la solution acide standard et réagit en sels d'ammonium avec l'acide faible ou fort.
La concentration en ions ammonium dans la solution acide, et donc la quantité d'azote dans l'échantillon, est mesurée par titrage. Si de l'acide borique (ou un autre acide faible) a été utilisé, le titrage acide-base direct est effectué avec un acide fort de concentration connue. HCl ou H 2 SO 4 peuvent être utilisés. Le titrage indirect en retour est utilisé à la place si des acides forts ont été utilisés pour préparer la solution acide standard : une base forte de concentration connue (comme NaOH) est utilisée pour neutraliser la solution. Dans ce cas, la quantité d'ammoniac est calculée comme la différence entre la quantité de HCl et de NaOH. Dans le cas du titrage direct, il n'est pas nécessaire de connaître la quantité exacte d'acide faible (par exemple l'acide borique) car il n'interfère pas avec le titrage (il doit être en excès d'ammoniac pour le piéger efficacement). Ainsi, une solution standard est nécessaire (par exemple HCl) dans le titrage direct, tandis que deux sont nécessaires (par exemple HCl et NaOH) dans le titrage en retour. L'un des indicateurs appropriés pour ces réactions de titrage est l'indicateur de Tashiro .
En pratique, cette analyse est largement automatisée ; des catalyseurs spécifiques accélèrent la décomposition. A l'origine, le catalyseur de choix était l'oxyde mercurique. Cependant, bien qu'il soit très efficace, des problèmes de santé l'ont amené à être remplacé par du sulfate cuivrique. Le sulfate de cuivre n'était pas aussi efficace que l'oxyde mercurique et a donné des résultats en protéines inférieurs. Il a rapidement été complété par du dioxyde de titane, qui est actuellement le catalyseur approuvé dans toutes les méthodes d'analyse des protéines dans les méthodes officielles et pratiques recommandées de l'AOAC International.
Applications
L'universalité, la précision et la reproductibilité de la méthode Kjeldahl en ont fait la méthode internationalement reconnue pour estimer la teneur en protéines des aliments et c'est la méthode standard par rapport à laquelle toutes les autres méthodes sont jugées. Il est également utilisé pour analyser les sols, les eaux usées, les engrais et d'autres matériaux. Cependant, il ne donne pas une mesure de la teneur réelle en protéines, car il mesure l'azote non protéique en plus de l'azote dans les protéines. En témoignent l' incident lié aux aliments pour animaux de compagnie en 2007 et le scandale du lait en poudre chinois de 2008 , lorsque de la mélamine , un produit chimique riche en azote, a été ajoutée aux matières premières pour simuler une teneur élevée en protéines. En outre, différents facteurs de correction sont nécessaires pour différentes protéines afin de tenir compte des différentes séquences d'acides aminés. Des inconvénients supplémentaires, tels que la nécessité d'utiliser de l'acide sulfurique concentré à haute température et le temps d'essai relativement long (une heure ou plus), se comparent défavorablement à la méthode Dumas pour mesurer la teneur en protéines brutes.
Azote total Kjeldahl
L'azote total Kjeldahl ou TKN est la somme de l' azote lié aux substances organiques, de l'azote dans l' ammoniac (NH 3 -N) et dans l' ammonium (NH 4 + -N) dans l'analyse chimique du sol, de l'eau ou des eaux usées (par exemple, traitement des eaux usées effluents de l'usine).
Aujourd'hui, le TKN est un paramètre obligatoire pour les rapports réglementaires dans de nombreuses usines de traitement et comme moyen de surveillance des opérations de l'usine.
Facteurs de conversion
Le TKN est souvent utilisé comme substitut des protéines dans les échantillons d'aliments . La conversion de TKN en protéine dépend du type de protéine présente dans l'échantillon et de la fraction de la protéine composée d' acides aminés azotés , comme l' arginine et l' histidine . Cependant, la gamme des facteurs de conversion est relativement étroite. Des exemples de facteurs de conversion, connus sous le nom de facteurs N, pour les aliments vont de 6,38 pour les produits laitiers et 6,25 pour la viande, les œufs, le maïs (maïs) et le sorgho à 5,83 pour la plupart des céréales ; 5,95 pour le riz, 5,70 pour la farine de blé et 5,46 pour les arachides. Dans la pratique, 6,25 est utilisé pour presque tous les aliments et aliments pour animaux, quelle que soit l'applicabilité. Le facteur 6,25 est spécifiquement requis par les réglementations américaines sur l'étiquetage nutritionnel en l'absence d'un autre facteur publié.
| Origine animale | Facteur | Graines d'herbe | Facteur | Haricots et cacahuètes | Facteur |
|---|---|---|---|---|---|
| Des œufs | 6,25 | Orge | 5.83 | poubelle Castor | 5.30 |
| Moi à | 6,25 | Maïs ( maïs ) | 6,25 | Haricot Jack | 6,25 |
| Du lait | 6,38 | millets | 5.83 | haricot de Lima | 6,25 |
| Avoine | 5.83 | Haricot bleu marine | 6,25 | ||
| Riz | 5,95 | Haricot mungo | 6,25 | ||
| Seigle | 5.83 | Soja | 5.71 | ||
| Sorgho | 6,25 | Fève de velours | 6,25 | ||
| Blé : Amande entière | 5.83 | Cacahuètes | 5.46 | ||
| Blé : Son | 6.31 | ||||
| Blé : Endosperme | 5.70 |
Sensibilité
La méthode Kjeldahl est peu sensible dans la version originale. D'autres méthodes de détection ont été utilisées pour quantifier le NH 4 + après minéralisation et distillation, obtenant une sensibilité améliorée : générateur d'hydrure en ligne couplé à un spectromètre d'émission atomique à plasma (ICP-AES-HG, 10-25 mg/L), titrage potentiométrique (> 0,1 mg d'azote), électrophorèse capillaire de zone (1,5 µg/ml d'azote) et chromatographie ionique (0,5 µg/ml).
Limites
La méthode Kjeldahl n'est pas applicable aux composés contenant de l'azote dans les groupes nitro et azo et l' azote présent dans les cycles (par exemple pyridine , quinoléine , isoquinoléine ) car l'azote de ces composés ne se transforme pas en sulfate d'ammonium dans les conditions de cette méthode.
Voir également
- Méthode Dumas , une autre méthode d'analyse de l'azote
- L'alliage de Devarda , un puissant agent réducteur pour l'analyse des nitrates
- Dosage de l'acide bicinchoninique , un dosage colorimétrique pour la protéine-azote
- Analyse de combustion une autre méthode d'analyse du carbone, de l'hydrogène et de l'azote
Les références
Bibliographie
- Ingénierie des eaux usées : traitement et réutilisation , Metcalf & Eddy, McGraw-Hill Higher Education ; 4e édition, 1er mai 2002, ISBN 978-0071241403
