Nafion - Nafion

|
|
| Identifiants | |
|---|---|
| ChemSpider | |
|
CID PubChem
|
|
|
Tableau de bord CompTox ( EPA )
|
|
| Propriétés | |
| C 7 HF 13 O 5 S . C 2 F 4 | |
| Masse molaire | Voir l'article |
| Dangers | |
| Pictogrammes SGH |

|
| Mention d'avertissement SGH | Avertissement |
| H319 , H335 | |
| P261 , P264 , P271 , P280 , P304+340 , P305+351+338 , P312 , P337+313 , P403+233 , P405 , P501 | |
| Composés apparentés | |
|
Composés apparentés
|
Aciplex Flemion Dowew fumapem F |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
Nafion est un nom de marque pour un fluoropolymère - copolymère à base de tétrafluoroéthylène sulfoné découvert à la fin des années 1960 par Walther Grot de DuPont . Nafion est une marque de la société Chemours. C'est le premier d'une classe de polymères synthétiques aux propriétés ioniques appelés ionomères . Les propriétés ioniques uniques de Nafion sont le résultat de l'incorporation de groupes éther perfluorovinylique terminés par des groupes sulfonate sur un squelette de tétrafluoroéthylène ( PTFE ). Nafion a reçu une attention considérable en tant que conducteur de protons pour les piles à combustible à membrane échangeuse de protons (PEM) en raison de son excellente stabilité thermique et mécanique.
La base chimique des propriétés conductrices supérieures de Nafion fait toujours l'objet de recherches approfondies. La conductivité ionique du Nafion augmente avec le niveau d'hydratation. L'exposition de Nafion à l'environnement humidifié ou à l'eau liquide augmente la quantité de molécules d'eau associées à chaque groupe acide sulfonique. La nature hydrophile des groupes ioniques attire les molécules d'eau, qui ont tendance à solvater les groupes ioniques et à dissocier les protons du groupe SO 3 H ( acide sulfonique ). Les protons dissociés « sautent » d'un site acide à un autre grâce à des mécanismes facilités par les molécules d'eau et la liaison hydrogène . Lors de l'hydratation, Nafion se sépare à des échelles nanométriques, ce qui entraîne la formation d'un réseau interconnecté de domaines hydrophiles qui permettent le mouvement de l'eau et des cations , mais les membranes ne conduisent pas d' anions ou d' électrons . Nafion peut être fabriqué sous diverses formes cationiques pour atteindre une gamme de conductivités cationiques.
Nomenclature et poids moléculaire
Le Nafion peut être produit à la fois sous forme de résine en poudre et de copolymère . Il a diverses configurations chimiques et donc plusieurs noms chimiques dans le système IUPAC . Nafion-H, par exemple, comprend les noms systématiques suivants :
- Extrait de Chemical Abstracts : fluorure d'éthanesulfonyle, 2-[1-[difluoro-[(trifluoroethenyl)oxy]methyl]-1,2,2,2-tetrafluoroethoxy]-1,1,2,2,-tetrafluoro-, avec du tétrafluoroéthylène
- copolymère d'acide tétrafluoroéthylène-perfluoro-3,6-dioxa-4-méthyl-7-octènesulfonique
Le poids moléculaire du Nafion est incertain en raison des différences de traitement et de morphologie de la solution. La structure d'une unité Nafion, illustrée en haut de la page, illustre la variabilité du matériau ; par exemple, le monomère le plus basique contient une variation de chaîne entre les groupes éther (l'indice z). Les méthodes conventionnelles de détermination du poids moléculaire telles que la diffusion de la lumière et la chromatographie par perméation de gel ne sont pas applicables car le Nafion est insoluble, bien que le poids moléculaire ait été estimé à 10 5 –10 6 Da. Au lieu de cela, le poids équivalent (EW) et l'épaisseur du matériau sont utilisés pour décrire la plupart des membranes disponibles dans le commerce. L'EW est le nombre de grammes de Nafion sec par mole de groupes acide sulfonique lorsque le matériau est sous forme acide. Membranes Nafion généralement classées en fonction de leur EW et de leur épaisseur. Par exemple, Nafion 117 indique une membrane moulée par extrusion avec 1100 g/mol EW et 0,007 pouce (7 000) d'épaisseur. Contrairement au poids équivalent, les résines échangeuses d'ions conventionnelles sont généralement décrites en termes de capacité d' échange d'ions (IEC), qui est l'inverse multiplicatif ou l'inverse du poids équivalent, c'est-à-dire IEC = 1000/EW.
Préparation
Les dérivés du nafion sont d'abord synthétisés par la copolymérisation de tétrafluoroéthylène (TFE) (le monomère dans le téflon) et d'un dérivé d'un perfluoro (alkyl vinyl éther) avec le fluorure d'acide sulfonyle. Ce dernier réactif peut être préparé par pyrolyse de son oxyde ou acide carboxylique respectif pour donner la structure oléfinée.
Le produit résultant est un thermoplastique contenant -SO 2 F qui est extrudé en films. Le NaOH aqueux chaud convertit ces groupes fluorure de sulfonyle (-SO 2 F) en groupes sulfonate (-SO 3 − Na + ). Cette forme de Nafion, dite forme neutre ou saline, est finalement convertie en la forme acide contenant les groupements acide sulfonique (-SO 3 H). Le nafion peut être coulé en couches minces par chauffage dans de l'alcool aqueux à 250 °C dans un autoclave . Par ce processus, Nafion peut être utilisé pour générer des films composites, revêtir des électrodes ou réparer des membranes endommagées.
Ce procédé de fabrication est assez coûteux.
Propriétés
La combinaison du squelette PTFE stable avec les groupes sulfoniques acides donne à Nafion ses caractéristiques :
- Il est hautement conducteur pour les cations, ce qui le rend adapté à de nombreuses applications membranaires.
- Il résiste aux attaques chimiques. Selon Chemours , seuls les métaux alcalins (en particulier le sodium) peuvent dégrader le Nafion à des températures et pressions normales.
- Le squelette PTFE entrelacé avec les groupes sulfonate ioniques donne à Nafion une température de fonctionnement élevée , par exemple jusqu'à 190 °C, cependant, sous forme de membrane, cela n'est pas possible en raison de la perte d'eau et de résistance mécanique.
- C'est un catalyseur superacide . La combinaison du squelette fluoré, des groupes acide sulfonique et de l'effet stabilisant de la matrice polymère font du Nafion un acide très fort, avec un pK a ~ -6. À cet égard, le Nafion ressemble à l' acide trifluorométhanesulfonique CF 3 SO 3 H, bien que le Nafion soit un acide plus faible d'au moins trois ordres de grandeur.
- Il est sélectivement et hautement perméable à l'eau.
- Sa conductivité protonique jusqu'à 0,2 S /cm en fonction de la température, de l'état d'hydratation, de l'historique thermique et des conditions de traitement
- La phase solide et la phase aqueuse de Nafion sont toutes deux perméables aux gaz, ce qui est un inconvénient pour les dispositifs de conversion d'énergie tels que les feuilles artificielles, les piles à combustible et les électrolyseurs à eau.
Structure/morphologie
La morphologie des membranes Nafion fait l'objet d'une étude continue pour permettre un meilleur contrôle de ses propriétés. D'autres propriétés telles que la gestion de l'eau, la stabilité à l'hydratation à haute température, la traînée électro-osmotique , ainsi que la stabilité mécanique, thermique et oxydative, sont affectées par la structure Nafion. Un certain nombre de modèles ont été proposés pour la morphologie de Nafion pour expliquer ses propriétés de transport uniques.
Le premier modèle pour Nafion, appelé cluster-channel ou cluster-network model , consistait en une distribution égale d'amas d'ions sulfonate (également décrits comme des « micelles inversées ») avec un diamètre de 40 Å (4 nm ) maintenu dans un réseau continu de fluorocarbures . Des canaux étroits d'environ 10 (1 nm) de diamètre relient les clusters, ce qui explique les propriétés de transport.
La difficulté de déterminer la structure exacte de Nafion provient de la solubilité et de la structure cristalline incohérentes de ses divers dérivés. Les modèles morphologiques avancés ont inclus un modèle noyau-enveloppe où le noyau riche en ions est entouré d'une enveloppe pauvre en ions, un modèle de tige où les groupes sulfoniques s'arrangent en tiges cristallines, et un modèle sandwich où le polymère forme deux couches dont les groupes sulfoniques les groupes s'attirent à travers une couche aqueuse où se produit le transport. La cohérence entre les modèles comprend un réseau de clusters ioniques ; les modèles diffèrent par la géométrie et la distribution des clusters. Bien qu'aucun modèle n'ait encore été déterminé complètement correct, certains scientifiques ont démontré qu'à mesure que la membrane s'hydrate, la morphologie de Nafion se transforme du modèle Cluster-Channel en un modèle en forme de tige.
Un modèle de canal d'eau cylindrique a également été proposé sur la base de simulations de données de diffusion des rayons X aux petits angles et d'études de résonance magnétique nucléaire à l'état solide. Dans ce modèle, les groupes fonctionnels d'acide sulfonique s'auto-organisent en réseaux de canaux d'eau hydrophiles, chacun d'environ 2,5 nm de diamètre, à travers lesquels les petits ions peuvent être facilement transportés. Entre les canaux hydrophiles se trouvent des squelettes polymères hydrophobes qui assurent la stabilité mécanique observée. De nombreuses études récentes, cependant, ont favorisé une nanostructure à phases séparées constituée de domaines hydrophiles localement plats ou en forme de ruban sur la base de preuves provenant d'études d'imagerie directe et d'une analyse plus complète de la structure et des propriétés de transport.
Applications
Les propriétés du Nafion le rendent adapté à un large éventail d'applications. Nafion a trouvé une utilisation dans les piles à combustible , les appareils électrochimiques, la production de chlore-alcali, la récupération des ions métalliques, l' électrolyse de l' eau , le placage , le traitement de surface des métaux, les batteries, les capteurs , les cellules de dialyse Donnan , la libération de médicaments, le séchage ou l'humidification des gaz et la catalyse superacide. pour la production de chimie fine. Nafion est également souvent cité pour son potentiel théorique (c'est-à-dire, jusqu'à présent non testé) dans un certain nombre de domaines. Compte tenu de la large fonctionnalité de Nafion, seules les plus importantes seront discutées ci-dessous.
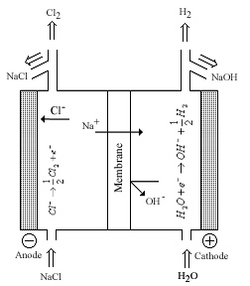
Membrane cellulaire de production de chlore-alcali
Le chlore et l'hydroxyde de sodium/potassium sont parmi les produits chimiques de base les plus produits au monde. Les méthodes de production modernes produisent du Cl 2 et du NaOH/KOH à partir de l'électrolyse de la saumure en utilisant une membrane Nafion entre les demi-cellules. Avant l'utilisation de Nafion, les industries utilisaient du mercure contenant de l'amalgame de sodium pour séparer le sodium métallique des cellules ou des diaphragmes en amiante afin de permettre le transfert des ions sodium entre les demi-cellules ; les deux technologies ont été développées dans la seconde moitié du 19e siècle. Les inconvénients de ces systèmes sont la sécurité des travailleurs et les préoccupations environnementales associées au mercure et à l'amiante, des facteurs économiques ont également joué un rôle et dans le procédé à diaphragme la contamination par le chlorure du produit hydroxyde. Nafion était le résultat direct de la réponse de l'industrie du chlore-alcali à ces préoccupations; Nafion pourrait tolérer les températures élevées, les courants électriques élevés et l'environnement corrosif des cellules électrolytiques.
La figure de droite montre une cellule chlore-alcali où Nafion fonctionne comme une membrane entre les demi-cellules. La membrane permet aux ions sodium de passer d'une cellule à l'autre avec une résistance électrique minimale. La membrane a également été renforcée avec des membranes supplémentaires pour empêcher le mélange des produits gazeux et minimiser le transfert en retour des ions Cl - et - OH.
Membrane échangeuse de protons (PEM) pour piles à combustible
Bien que les piles à combustible soient utilisées depuis les années 1960 comme alimentations électriques pour les satellites, elles ont récemment reçu une attention renouvelée pour leur potentiel à produire efficacement de l'énergie propre à partir de l'hydrogène. Le nafion s'est avéré efficace comme membrane pour les piles à combustible à membrane échangeuse de protons (PEM) en permettant le transport des ions hydrogène tout en empêchant la conduction des électrons. Les électrolytes polymères solides, qui sont fabriqués en connectant ou en déposant des électrodes (généralement en métal noble) des deux côtés de la membrane, conduisent les électrons à travers un processus nécessitant de l'énergie et rejoignent les ions hydrogène pour réagir avec l'oxygène et produire de l'eau. On s'attend à ce que les piles à combustible trouvent une forte utilisation dans l'industrie des transports.
Catalyseur superacide pour la production de chimie fine
Le nafion, en tant que superacide , a un potentiel de catalyseur pour la synthèse organique . Des études ont démontré des propriétés catalytiques dans l' alkylation , l' isomérisation , l' oligomérisation , l' acylation , la cétalisation , l' estérification , l' hydrolyse des sucres et des éthers et l' oxydation . De nouvelles applications sont constamment découvertes. Ces procédés, cependant, n'ont pas encore trouvé d'utilisation commerciale forte. Plusieurs exemples sont présentés ci-dessous :
L'alkylation avec des halogénures d'alkyle
Nafion-H donne une conversion efficace alors que la méthode alternative, qui utilise la synthèse de Friedel-Crafts , peut favoriser la polyalkylation :
Acylation
La quantité de Nafion-H nécessaire pour catalyser l'acylation du benzène avec du chlorure d'aroyle est de 10 à 30 % inférieure à celle du catalyseur Friedel-Crafts :
La catalyse des groupes de protection
Nafion-H augmente les taux de réaction de protection via le dihydropyrane ou la o-trialkylsilation d'alcools, de phénol et d'acides carboxyliques.
Isomérisation
Nafion peut catalyser un déplacement 1,2-hydrure .
Il est possible d'immobiliser des enzymes au sein du Nafion en élargissant les pores avec des sels lipophiles . Nafion maintient une structure et un pH pour fournir un environnement stable pour les enzymes. Les applications incluent l'oxydation catalytique des adénine dinucléotides .
Capteurs
Nafion a trouvé une utilisation dans la production de capteurs , avec des applications dans les capteurs sélectifs d'ions, métallisés, optiques et biocapteurs . Ce qui rend Nafion particulièrement intéressant, c'est sa démonstration de biocompatibilité . Il a été démontré que Nafion est stable dans les cultures cellulaires ainsi que dans le corps humain, et des recherches considérables sont en cours pour la production de capteurs de glucose à plus haute sensibilité .
Surfaces antimicrobiennes
Les surfaces Nafion présentent une zone d'exclusion contre la colonisation bactérienne. De plus, les revêtements couche par couche comprenant Nafion présentent d'excellentes propriétés antimicrobiennes.
Déshumidification dans les engins spatiaux
Le vaisseau spatial SpaceX Dragon 2 à capacité humaine utilise des membranes Nafion pour déshumidifier l'air de la cabine. Un côté de la membrane est exposé à l'atmosphère de la cabine, l'autre au vide de l'espace. Il en résulte une déshumidification puisque Nafion est perméable aux molécules d'eau mais pas à l'air. Cela permet d'économiser de l'énergie et de la complexité car le refroidissement n'est pas nécessaire (comme cela est nécessaire avec un déshumidificateur à condensation) et l'eau retirée est rejetée dans l'espace sans mécanisme supplémentaire nécessaire.
Nafion modifié pour piles à combustible PEM
Le Nafion normal se déshydrate (et perd donc sa conductivité protonique) lorsque la température est supérieure à ~80 °C. Cette limitation perturbe la conception des piles à combustible car des températures plus élevées sont souhaitables pour une meilleure efficacité et une meilleure tolérance au CO du catalyseur au platine. La silice et le phosphate de zirconium peuvent être incorporés dans les canaux d'eau Nafion par des réactions chimiques in situ pour augmenter la température de travail au-dessus de 100 °C.
Les références
Liens externes
- Quelle membrane Nafion convient à un électrolyseur/génération d'hydrogène ?
- Page d'accueil de Walther G. Grot
- Walther G. Grot : « Ionomeres fluorés »
- Effets isotopiques sur la conductivité du Nafion
- Epaisseur de membrane sur conductivity_of_Nafion
- Nafion hydratation
- Nafion Totally Explained à la Wayback Machine (archivé le 22 septembre 2007)