Orientia tsutsugamushi -Orientia tsutsugamushi
| Orientia tsutsugamushi | |
|---|---|
|
|
| Orientia tsutsugamushi | |
| Classement scientifique | |
| Domaine: | |
| Phylum: | |
| Classer: | |
| Commander: | |
| Famille: | |
| Genre: | |
| Espèce: |
O. tsutsugamushi
|
| Nom binomial | |
|
Orientia tsutsugamushi (Hayashi, 1920) (Ogata, 1929) Tamura et al. , 1995
|
|
Orientia tsutsugamushi (du japonais tsutsuga signifiant « maladie » et mushi signifiant « insecte ») est une bactérie transmise par les acariens appartenant à la famille des Rickettsiaceae et est responsable d'une maladie appelée typhus des broussailles chez l'homme. C'est un parasite intracellulaire naturel et obligatoire des acariens appartenant à la famille des Trombiculidae . Avec un génome de seulement 2,0 à 2,7 Mb, il possède les séquences d'ADN les plus répétées parmi les génomes bactériens séquencés à ce jour. La maladie, le typhus des broussailles, survient lorsque des larves d'acariens infectés piquent accidentellement des humains. Principalement indiquée par des maladies fébriles indifférenciées, l'infection peut être compliquée et souvent mortelle.
L' infection à Orientia tsutsugamushi a été signalée pour la première fois au Japon par Hakuju Hashimoto en 1810, et dans le monde occidental par Theobald Adrian Palm en 1878. Naosuke Hayashi l'a décrite pour la première fois en 1920, donnant le nom de Theileria tsutsugamushi . En raison de ses propriétés uniques, il a été rebaptisé tsutsugamushi Orientia en 1995. Contrairement à d' autres bactéries Gram-négatives bactéries , il est pas facilement teinté avec coloration de Gram , comme sa paroi cellulaire est dépourvue de lipophosphoglycane et peptidoglycane . Avec une protéine membranaire très variable, une protéine de 56 kDa, la bactérie peut être classée antigéniquement en de nombreuses souches (sous-types). Les souches classiques sont Karp (qui représente environ 50 % de toutes les infections), Gilliam (25 %), Kato (moins de 10 %), Shimokoshi, Kuroki et Kawasaki. Au sein de chaque souche, une énorme variabilité existe en outre.
Orientia tsutsugamushi se maintient naturellement dans la population d'acariens par transmission de la femelle à ses œufs (transmission transovarienne), et des œufs aux larves puis aux adultes (transmission transstadiale). Les larves d'acariens, appelées aoûtats , sont des ectoparasites naturels des rongeurs. Les humains sont infectés lors d'un contact accidentel avec des aoûtats infectés. Une croûte en forme de cicatrice appelée escarre est un bon indicateur d'infection, mais n'est pas omniprésente. La bactérie est endémique au soi-disant Triangle de Tsutsugamushi, une région couvrant l'Extrême-Orient russe au nord, le Japon à l'est, le nord de l'Australie au sud et l'Afghanistan à l'ouest. On estime qu'un million d'infections surviennent chaque année. Les antibiotiques tels que l' azithromycine et la doxycycline sont les principaux médicaments d'ordonnance; le chloramphénicol et la tétracycline sont également efficaces. Le diagnostic de l'infection est difficile et nécessite des techniques laborieuses telles que le test de Weil-Felix , le test immunochromatographique rapide , les tests d'immunofluorescence et l' amplification en chaîne par polymérase . Il n'existe pas de vaccin contre l'infection.
Histoire
Le premier signalement d' infection à O. tsutsugamushi remonte au IIIe siècle (313 de notre ère) en Chine. Les Japonais connaissaient également le lien entre l'infection et les acariens pendant des siècles. Ils ont donné plusieurs noms tels que shima-mushi , akamushi (acarien rouge) ou maladie de kedani (acarien poilu) du nord du Japon, et plus communément tsutsugamushi (de tsutsuga signifiant fièvre ou mal ou maladie, et mushi signifiant insecte ou insecte). Le médecin japonais Hakuju Hashimoto a donné le premier compte rendu médical de la préfecture de Niigata en 1810. Il a enregistré la prévalence de l'infection le long des rives des affluents supérieurs de la rivière Shinano . Le premier rapport au monde occidental a été fait par Theobald Adrian Palm, médecin de la Edinburgh Medical Missionary Society à Niigata en 1878. Décrivant son expérience de première main, Palm a écrit :
L'été dernier [c'est-à-dire 1877], j'ai eu l'occasion d'observer une maladie qui, à ma connaissance, est particulière au Japon et n'a pas encore été décrite. Elle se produit d'ailleurs dans certains quartiers bien marqués et à une certaine saison de l'année, de sorte que les occasions de l'étudier ne se présentent pas souvent. Elle est connue ici sous le nom de shima-mushi , ou maladie des insectes des îles, et est ainsi nommée en raison de la croyance qu'elle est causée par la morsure ou la piqûre d'un insecte particulier à certaines îles de la rivière connue sous le nom de Shinagawa, qui se vide. dans la mer à Niigata.
L'étiologie de la maladie était inconnue jusqu'au début du 20e siècle. En 1908, une théorie des acariens sur la transmission de la maladie de tsutsugamushi a été postulée par Taichi Kitashima et Mikinosuke Miyajima. En 1915, un zoologiste britannique, Stanley Hirst, a suggéré que les larves d'acarien Microtrombidium akamushi (rebaptisé plus tard Leptotrombidium akamushi ) qu'il avait trouvées sur les oreilles de mulots pouvaient porter et transmettre l'infection. En 1917, Mataro Nagayo et ses collègues ont donné la première description complète des stades de développement tels que l'œuf, la nymphe, la larve et l'adulte de l'acarien. Ils ont également affirmé que seules les larves piquent les mammifères, et sont donc les seuls porteurs des parasites. Mais alors, l'agent infectieux réel n'était pas connu, et il était généralement attribué à un virus ou à un protozoaire.
L'agent pathogène en cause a été identifié pour la première fois par Naosuke Hayashi en 1920. Confiant que l'organisme était un protozoaire, Hayashi a conclu, déclarant : « Je suis parvenu à la conclusion que le virus de la maladie est l'espèce de Piroplasma [protozoaire] en question... Je considère l'organisme de la maladie de Tsutsugamushi comme une espèce jusqu'ici non décrite et, sur la suggestion du Dr Henry B. Ward, je le désigne sous le nom de Theileria tsutsugamushi ." Découvrant les similitudes avec la bactérie R. prowazekii , Mataro Nagayo et ses collègues ont donné une nouvelle classification sous le nom de Rickettsia orientalis en 1930. ( R. prowazekii est une bactérie responsable du typhus épidémique découverte pour la première fois par les médecins américains Howard Taylor Ricketts et Russell M. Wilder en 1910, et décrit par un médecin brésilien Henrique da Rocha Lima en 1916.)
La confusion taxonomique s'est aggravée. En 1931, Norio Ogata donna le nom de Rickettsia tsutsugamushi , tandis que Rinya Kawamüra et Yoso Imagawa introduisirent indépendamment le nom Rickettsia akamushi . Kawamüra et Imagawa ont découvert que les bactéries sont stockées dans les glandes salivaires des acariens et que les acariens se nourrissent de fluide corporel (lymphe), établissant ainsi le fait que les acariens transmettent les parasites pendant l'alimentation.
Pendant plus de 60 ans, il n'y avait pas eu de consensus sur le choix du nom – R. orientalis et R. tsutsugamushi étaient également utilisés. Akira Tamura et ses collègues ont signalé en 1991 les différences structurelles de la bactérie des espèces de Rickettsia qui justifiaient un genre séparé, et ont proposé le nom Orientia tsutsugamushi . Enfin, en 1995, ils ont fait une nouvelle classification basée sur les propriétés morphologiques et biochimiques, créant formellement le nouveau nom O. tsutsugamushi .
La biologie
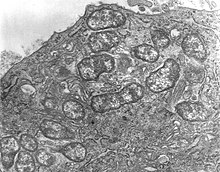
Orientia tsutsugamushi est une bactérie à Gram négatif et est un parasite permanent (obligatoire) chez les acariens. Au sein d'une seule cellule hôte, O. tsutsugamushi se divise rapidement en plusieurs individus, comme le montre la figure 1 . Organisme unicellulaire, il est de forme ovale et mesure 0,5 à 0,8 µm de large et 1,2 à 3,0 µm de long. En raison de la similitude, il était auparavant classé dans le genre Rickettsia parmi d'autres bactéries, mais a ensuite été attribué à un genre distinct, Orientia , qu'il partage (à partir de 2010) uniquement avec Candidatus Orientia chuto . Elle est plus large mais plus courte que les autres bactéries rickettsiennes, qui sont en forme de bâtonnet et mesurent en moyenne 0,25 à 0,3 µm de large et 0,8 à 1 µm de long. Lors de la reproduction, il se divise (par fission binaire ) en deux cellules filles par le processus de bourgeonnement. Au cours du bourgeonnement, il s'accumule à la surface de la cellule hôte, contrairement à d'autres bactéries. Un cycle de bourgeonnement complet dure de 9 à 18 heures.
La structure d' O. tsutsugamushi ( révélée par microscopie électronique à transmission ) est illustrée à la figure 2 . La bactérie est entourée d'une paroi cellulaire à l'extérieur et d'une membrane cellulaire à l'intérieur. Le revêtement cellulaire absorbe les taches telles que les taches de Giemsa et de Gimenez . Bien que sa paroi cellulaire ait une double couche bactérienne classique, son feuillet externe est beaucoup plus épais que celui interne, ce qui est tout le contraire chez les espèces de Rickettsia . Une couche de capsule qui forme un halo sphérique chez d'autres bactéries est manquante. La paroi cellulaire est moins rigide en raison de l'absence de peptidoglycane, qui est par ailleurs caractéristique des parois cellulaires rigides d'autres bactéries. Les lipophosphoglycanes bactériens classiques tels que l' acide muramique , la glucosamine , les acides gras hydroxylés, l' heptose et l'acide 2-céto-3-désoxyoctonique sont également absents de la paroi cellulaire. En raison de l'absence de peptidoglycane , la bactérie est naturellement résistante à tous les antibiotiques β-lactamines (comme la pénicilline ), auxquels les espèces de Rickettsia sont normalement sensibles. Son génome est totalement dépourvu des gènes de synthèse des lipophosphoglycanes, mais en contient certains pour ceux du peptidoglycane. Des gènes importants essentiels à la synthèse du peptidoglycane tels que alr , dapF et PBP1 sont manquants : alr code pour une enzyme L-alanine racémase, qui convertit la L-alanine en D-alanine dans la première étape de la voie de synthèse du peptidoglycane ; dapF code pour la diaminopimélate épimérase, qui convertit le LL-2,6-diaminoheptanedioate (L,L-DAP) en méso-diaminoheptanedioate (méso-DAP); et PBP1 code pour la protéine de liaison à la pénicilline-1 (PBP1), qui convertit le lipide II périplasmique en peptidoglycane. Ainsi, la bactérie ne peut pas synthétiser une paroi cellulaire typique de peptidoglycane et forme à la place une structure de type peptidoglycane à sa surface. La membrane cellulaire est également chimiquement différente dans sa composition protéique, et cette différence donne lieu à des variations de souche au sein de l'espèce elle-même. Le cytoplasme est clair et montre un ADN et des ribosomes distincts.
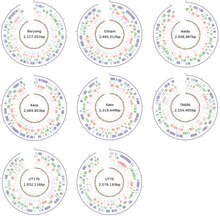
La bactérie est très virulente, de sorte que son isolement et sa culture cellulaire se font uniquement dans un laboratoire de niveau de biosécurité 3 . Contrairement à d'autres bactéries qui peuvent facilement se développer sur différents milieux de culture, les rickettsiales ne peuvent être cultivées que dans des cellules vivantes. O. tsutsugamushi ne peut être cultivé que dans les sacs vitellins d'embryons de poulet en développement et dans des lignées cellulaires cultivées telles que HeLa , BHK , Vero et L929 . Contrairement aux espèces de Rickettsia qui résident dans le noyau de la cellule hôte, O. tsutsugamushi se développe principalement dans le cytoplasme de la cellule hôte. Génétiquement, il ne diffère des autres Rickettsia que de 9 %. Même si l'adaptation au parasitisme intracellulaire obligatoire chez les bactéries entraîne généralement un génome réduit, il a une taille de génome d'environ 2,0 à 2,7 Mb selon les souches ( Figure 3 ), ce qui est comparativement plus grand que celui des autres rickettsies - deux fois plus grand que celui de Rickettsia prowazekii , le membre le plus connu. L'ensemble du génome est distribué dans un seul chromosome circulaire. Les séquences du génome entier ne sont disponibles que pour les souches Ikeda et Boryong, toutes deux originaires de la République de Corée. Le génome de la souche Ikeda est long de 2 008 987 paires de bases (pb) et contient 1 967 gènes codant pour des protéines. La souche Boryong est plus grande avec 2 127 051 pb et 2 179 gènes codant pour des protéines.
La comparaison du génome ne montre que 657 gènes centraux parmi les différentes souches. Avec environ 42 à 47 % de séquences répétitives, O. tsutsugamushi possède le génome bactérien le plus répété séquencé en 2013. La séquence d'ADN répétée comprend de courtes séquences répétitives , des éléments transposables (y compris des éléments de séquence d'insertion, des éléments transposables à répétition inversée miniature, un intron du groupe II ) et un élément intégratif et conjugatif fortement amplifié (ICE) appelé élément génétique amplifié rickettsien (RAGE). RAGE est également présent dans d'autres bactéries rickettsiennes. Chez O. tsutsugamushi , cependant, RAGE contient un certain nombre de gènes, y compris les gènes tra typiques des systèmes de sécrétion de type IV et le gène de la protéine contenant des répétitions ankyrine . Les protéines contenant des répétitions d'ankyrine sont sécrétées par un système de sécrétion de type I dans la cellule hôte. Le rôle précis du système de sécrétion de type IV chez O. tsutsugamushi n'est pas connu. Il peut être impliqué dans le transfert horizontal de gènes entre les différentes souches.
Cycle de vie et transmission
Orientia tsutsugamushi est naturellement transmis dans la population d'acariens appartenant au genre Leptotrombidium . Il peut être transmis par une femelle à ses œufs par le processus appelé transmission transovarienne, et des œufs aux larves et aux adultes par le processus de transmission transstadienne. Ainsi, le cycle de vie bactérien est entièrement maintenu chez les acariens. L'infection des rongeurs et des humains est une transmission accidentelle par piqûre de larves d'acariens et n'est pas nécessaire à la reproduction ou à la survie de la bactérie. En fait, chez l'homme, la transmission est stoppée, et la bactérie se retrouve dans une impasse. Cependant, les acariens non infectés peuvent contracter l'infection à partir de rongeurs infectés.
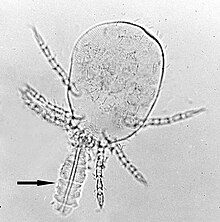
Chez les rongeurs et les infections humaines, Leptotrombidium deliense est le vecteur le plus courant d' O . tsutsugamushi . L. pallidum , L. fletcheri et L. scutellare sont également porteurs dans de nombreux pays. De plus, L. akamushi est un vecteur endémique au Japon, L. chiangraiensis et L. imphalum en Thaïlande, L. gaohuensis en Chine et L. arenicola en Malaisie et en Indonésie. Dans certaines parties de l'Inde, une espèce d'acariens différente, Schoengastiella ligula est également un vecteur majeur. Le cycle de vie des acariens comprend l'œuf, la prélarve, la larve, la protonymphe, le deutonymphe, la tritonymphe et l'adulte. Les larves, communément appelées aoûtats ( Figure 4 ), sont le seul stade ectoparasitaire qui se nourrit des fluides corporels des rongeurs et autres mammifères opportunistes. Ainsi, ils sont la seule étape de la vie des acariens qui transmettent l'infection. Les rats sauvages du genre Rattus sont les principaux hôtes naturels des aoûtats. Les aoûtats se nourrissent une seule fois d'un hôte mammifère. L'alimentation prend généralement 2 à 4 jours. Contrairement à la plupart des parasites, ils ne se nourrissent pas de sang, mais plutôt de fluides corporels à travers les follicules pileux ou les pores de la peau. Ils possèdent un appareil d'alimentation spécial appelé Stylostome , qui est un tube formé par la salive solidifiée. Leur salive peut dissoudre le tissu hôte autour du site d'alimentation, de sorte qu'ils ingèrent le tissu liquéfié. O. tsutsugamushi est présent dans les glandes salivaires des acariens et est libéré dans les tissus de l'hôte au cours de cette alimentation.
Invasion cellulaire
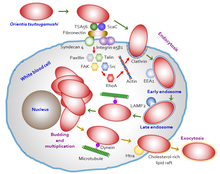
Orientia tsutsugamushi attaque d'abord les myélocytes (jeunes globules blancs) dans la zone d'inoculation, puis les cellules endothéliales tapissant le système vasculaire . Le processus d' invasion cellulaire est illustré à la figure 5 . Dans la circulation sanguine, il cible les phagocytes professionnels (« mangeurs de cellules », globules blancs) tels que les cellules dendritiques et les macrophages dans tous les organes comme cibles secondaires. Le parasite s'attache d'abord aux cellules cibles en utilisant des protéoglycanes de surface présents sur la cellule hôte et des protéines de surface bactériennes telles que la protéine spécifique de type 56 (ou l'antigène spécifique de type, TSA56) et les antigènes des cellules de surface (ScaA et ScaC, qui sont des protéines de transport membranaire). . Ces protéines interagissent avec la fibronectine hôte pour induire la phagocytose (le processus d'ingestion de la bactérie). La capacité d'entrer réellement dans la cellule hôte dépend de la signalisation médiée par l' intégrine et de la réorganisation du cytosquelette d' actine .
Orientia tsutsugamushi a une adaptation spéciale pour survivre dans la cellule hôte en évitant la réaction immunitaire de l'hôte. Une fois qu'il interagit avec les cellules hôtes, la membrane de la cellule hôte forme une bulle de transport appelée vésicule recouverte de clathrine par laquelle elle est transportée dans le cytoplasme. À l'intérieur du cytoplasme, il fait une sortie de la vésicule (maintenant connue sous le nom d' endosome ) avant que l'endosome ne soit détruit (au cours du processus de consommation de cellules appelé autophagie ) par les lysosomes . Il se dirige ensuite vers le noyau, plus précisément dans la région périnucléaire, où il commence à croître et à se multiplier. Contrairement à d'autres bactéries étroitement apparentées qui utilisent des processus induits par l'actine pour se déplacer dans le cytoplasme (appelés trafic ou transport intracellulaire ), O. tsutsugamushi est inhabituel dans l'utilisation de processus induits par les microtubules similaires à ceux employés par des virus tels que les adénovirus et les virus de l'herpès simplex . En outre, la fuite ( exocytose ) d'une cellule hôte infectée est également inhabituelle. Il forme une autre vésicule à l'aide de la membrane de la cellule hôte, donne naissance à un petit bourgeon et se libère de la surface de la cellule hôte tout en restant enfermé dans la vésicule. La bactérie liée à la membrane est formée par interaction entre des radeaux lipidiques riches en cholestérol et HtrA, une protéine de 47 kDa à la surface bactérienne. Cependant, le processus de bourgeonnement et l'importance de la bactérie liée à la membrane ne sont pas encore compris.
Souches
Orientia tsutsugamushi est une espèce diversifiée de bactéries. Ida A. Bengtson du Service de santé publique des États-Unis a été la première à noter l'existence de différentes souches utilisant l'interaction antigène-anticorps ( test de fixation du complément ) en 1944. Elle a observé que différentes souches avaient un degré variable de virulence, et que les anticorps dans les sérums sanguins des patients réagissent de manière croisée à différentes souches. En 1946, elle a établi qu'il existait trois souches principales (sérotypes), à savoir Karp (de Nouvelle-Guinée), Gilliam (de l'Inde) et Seerangay (de la Malaisie britannique). Akira Shishido a décrit la souche Kato, en plus de Gilliam et Karp, au Japon en 1958. Depuis lors, six souches antigéniques de base sont reconnues, à savoir Gilliam, Karp, Kato, Shimokoshi, Kawasaki et Kuroki. Karp est la souche la plus abondante, représentant environ 50% de toutes les infections. En Corée, la souche principale est la Boryong. En 2009, plus de 20 souches différentes ont été établies chez l'homme sur la base de la variation antigénique à l'aide de tests sérologiques tels que la fixation du complément et le test d'immunofluorescence. Le nombre est beaucoup plus élevé si les souches chez les rongeurs et les acariens sont prises en compte. Par exemple, une étude au Japon en 1994 a signalé 32 souches, 14 provenant de patients humains, 12 de rongeurs sauvages et 6 d'acariens trombiculides. Les différentes souches exercent différents niveaux de virulence, et la plus virulente est KN-3, qui est prédominante chez les rongeurs sauvages. Une autre étude en 1996 a rapporté 40 souches. Les méthodes génétiques ont révélé une complexité encore plus grande que ce qui avait été décrit précédemment (par exemple, Gilliam est encore divisé en types Gilliam et JG). En raison des différences immunologiques des sérotypes, une infection simultanée et répétée avec différentes souches est possible.
Variation antigénique
Orientia tsutsugamushi possède quatre principales protéines de membrane de surface ( antigènes ) ayant des poids moléculaires de 22 kDa, 47 kDa, 56 kDa et 110 kDa. Un antigène spécifique de type 56 kDa (TSA56) est le plus important car il n'est produit par aucune autre bactérie, et est responsable de la diversité génétique des différentes souches. Il représente environ 10 à 15 % des protéines cellulaires totales. Les antigènes de 22 kDa, 47 kDa ou 110 kDa ne sont pas spécifiques de la souche, de sorte que TSA56 est la cible principale des tests de diagnostic sophistiqués tels que l'immunotransfert, l'ELISA et l'analyse ADN. La protéine aide à l'adhésion et à l'entrée de la bactérie dans les cellules hôtes, ainsi qu'à l'évasion de la réaction immunitaire de l'hôte. Sa taille varie de 516 à 540 résidus d'acides aminés entre différentes souches, et son gène a une longueur d'environ 1 550 paires de bases. Son gène contient quatre régions hypervariables, indiquant qu'il synthétise de nombreuses protéines antigéniquement différentes. Il existe également des protéines de 11 kDa et 60 kDa à l'intérieur de la bactérie qui sont très similaires à GroES et GroEL de la bactérie Escherichia coli , mais pas à celles de l' espèce Rickettsia . GroES et GroEL sont des protéines de choc thermique appartenant à la famille des chaperons moléculaires chez les bactéries. Des analyses d'ADN ont montré que les gènes GroES et GroEL sont bien présents chez O. tsutsugamushi avec une légère variation selon les différentes souches, et qu'ils produisent les protéines de 11 kDa et 60 kDa.
Maladie
Orientia tsutsugamushi provoque une maladie complexe et potentiellement mortelle connue sous le nom de typhus des broussailles. L'infection commence lorsque les aoûtats mordent la peau pendant leur alimentation. Les bactéries se déposent au site d'alimentation (inoculation), où elles se multiplient. Ils provoquent des lésions tissulaires progressives ( nécrose ), ce qui conduit à la formation d'une escarre sur la peau. La nécrose évolue vers une inflammation des vaisseaux sanguins, appelée vascularite . Cela provoque à son tour une inflammation des ganglions lymphatiques, appelée lymphadénopathie . En quelques jours, la vascularite s'étend à divers organes dont le foie, le cerveau, les reins, les méninges et les poumons. La maladie est responsable de près d'un quart de toutes les maladies fébriles (fièvre élevée) dans les zones d'endémie. La mortalité dans les cas graves ou due à un traitement inapproprié ou à un diagnostic erroné peut atteindre 30 à 70 %. Environ 6 % des personnes infectées meurent sans traitement et 1,4 % des patients meurent même avec un traitement médical. De plus, le taux de mortalité peut atteindre 14 % avec des problèmes neurologiques et 24 % avec un dysfonctionnement de plusieurs organes chez les patients traités. En cas de diagnostic erroné et d' échec du traitement , des complications systémiques se développent rapidement , notamment syndrome de détresse respiratoire aiguë , insuffisance rénale aiguë , encéphalite , saignement gastro-intestinal , hépatite , méningite , myocardite , pancréatite , pneumonie , choc septique , thyroïdite subaiguë et syndrome de dysfonctionnement de plusieurs organes . Les effets nocifs impliquant une défaillance multiviscérale et des troubles neurologiques sont difficiles à traiter et peuvent entraîner un affaiblissement permanent ou être directement mortels. Le système nerveux central est souvent touché et entraîne diverses complications dont la cérébellite , les paralysies des nerfs crâniens , la méningo - encéphalite , la plexopathie , la myélite transverse et le syndrome de Guillan-Barré . Les taux de mortalité dus aux complications peuvent atteindre 14% dans les infections cérébrales et 24% dans les défaillances multiviscérales. En Inde, le typhus des broussailles est devenu la principale cause du syndrome d'encéphalite aiguë, qui était auparavant principalement causé par une infection virale, l'encéphalite japonaise .
Épidémiologie
L' Organisation mondiale de la santé a déclaré en 1999 que :
Le typhus des broussailles est probablement l'une des maladies fébriles les plus sous-diagnostiquées et sous-déclarées nécessitant une hospitalisation dans la région. L'absence de signes et de symptômes définitifs combinée à une dépendance générale aux tests sérologiques rendent assez difficile la différenciation du typhus des broussailles d'autres maladies fébriles courantes telles que le typhus murin, la fièvre typhoïde et la leptospirose.
Le typhus des broussailles est historiquement endémique à la région Asie-Pacifique, couvrant l'Extrême-Orient russe et la Corée au nord, le nord de l'Australie au sud et l'Afghanistan à l'ouest, y compris les îles de l'océan Pacifique occidental telles que le Japon, Taïwan, les Philippines , la Papouasie-Nouvelle-Guinée, l'Indonésie, le Sri Lanka et le sous-continent indien. Cette région géographique est communément appelée le Triangle de Tsutsugamushi , comme le montre la figure 6 . Cependant, il s'est propagé à l'Afrique, l'Europe et l'Amérique du Sud. On estime qu'un milliard de personnes sont à risque d'infection à tout moment et qu'un million de cas en moyenne surviennent chaque année dans le triangle de Tsutsugamushi. Le fardeau du typhus des broussailles dans les zones rurales d'Asie est énorme, représentant jusqu'à 20 % des maladies fébriles à l'hôpital, et la séroprévalence (infection positive au test sanguin) plus de 50 % de la population. Plus d'un cinquième de la population est porteur des anticorps bactériens, c'est-à-dire qu'ils ont été infectés, dans les zones d'endémie. La Corée du Sud a le niveau d'incidence le plus élevé (avec son plus haut niveau de 59,7 infections sur 100 000 personnes en 2013), suivie du Japon, de la Thaïlande et de la Chine en tête de liste. Le groupe d'âge des 60-69 ans est le plus à risque d'infection. Une infection plus élevée (57,3 %) est observée chez les femmes par rapport aux hommes (42,7 %). Les agriculteurs sont les plus vulnérables, représentant 70 % des cas en Chine. La maladie est plus répandue dans les zones rurales, mais il y a une augmentation rapide dans les zones urbaines. Par exemple, en Corée, l'incidence annuelle a été multipliée par 21 entre 2003 et 2013 dans les zones métropolitaines.
Diagnostic
Symptôme
Le principal symptôme de l' infection à O. tsutsugamushi est une fièvre élevée (fébrile); cependant, le symptôme est similaire à celui d'autres maladies tropicales à transmission vectorielle telles que le paludisme , la leptospirose , la typhoïde , le typhus murin , le chikungunya et la dengue . Cela rend difficile un diagnostic clinique précis, ce qui conduit souvent à des erreurs de diagnostic. Les indications initiales sont la fièvre avec frissons, associée à des maux de tête, des douleurs musculaires ( myalgies ), des sueurs et des vomissements. L'apparition des symptômes ( la période d'incubation ) prend entre 6 et 21 jours. Un diagnostic visuel simple est la présence d'une croûte enflammée ressemblant à une cicatrice appelée escarre, qui est considérée comme "l'indice diagnostique le plus utile chez les patients atteints d'une maladie fébrile aiguë". L'escarre se forme sur la peau à l'endroit où un acarien infecté a mordu, généralement observé au niveau de l'aisselle, de l'aine ou de toute région abdominale ( Figure 7 ). Dans de rares cas, il peut être vu sur la joue, le lobe de l'oreille et le dos des pieds . Mais, le problème est que l'escarre n'est pas toujours présente ; au record le plus élevé, seulement 55% des patients atteints de typhus broussailleux avaient une escarre lors d'une épidémie dans le sud de l'Inde. En outre, l'escarre n'est pas spécifique au typhus des broussailles, présent dans d' autres maladies à rickettsies telles que la fièvre pourprée des montagnes Rocheuses, la fièvre pourprée brésilienne et le typhus à tiques indien. En utilisant l'analyse de l'ADN par réaction en chaîne par polymérase avancée, différentes infections à rickettsies peuvent être identifiées à partir des escarres.
Test sanguin
Les infections suspectées sont confirmées par des tests sérologiques. O. tsutsugamushi est le plus souvent détecté dans le sérum sanguin à l'aide du test de Weil-Felix . Weil-Felix est le test le plus simple et le plus rapide, mais il n'est ni sensible ni spécifique, car il détecte tout type d'infection à rickettsies. Des tests plus sensibles tels que le test immunochromatographique rapide (RICT), les tests d'immunofluorescence (IFA), l'ELISA et l'analyse de l'ADN par amplification en chaîne par polymérase (PCR) sont utilisés. L'IFA est considéré comme le test de référence, car il donne un résultat fiable ; cependant, il est coûteux et n'est pas spécifique aux différentes bactéries rickettsiennes. ELISA et PCR peuvent détecter des protéines spécifiques à O. tsutsugamushi telles que TSA56 et GroEL, de sorte qu'elles sont hautement spécifiques et sensibles. D'autre part, ce sont des techniques très sophistiquées et coûteuses.
Traitement
L' infection à Orientia tsutsugamushi peut être traitée avec des antibiotiques tels que l' azithromycine , le chloramphénicol , la doxycycline , la rifampicine , la roxithromycine et la tétracycline . La doxycycline est la plus couramment utilisée et est considérée comme le médicament de choix en raison de sa grande efficacité et de sa rapidité d'action. Mais, chez les femmes enceintes et les bébés, il est contre - indiqué et l'azithromycine est le médicament de choix. En Asie du Sud-Est, où la résistance à la doxycycline et au chloramphénicol a été observée, l'azithromycine est recommandée pour tous les patients. Un essai contrôlé randomisé et une revue systématique ont montré que l'azithromycine est le médicament le plus sûr.
Vaccin
Aucun vaccin homologué contre O. tsutsugamushi n'est actuellement disponible. Les premiers vaccins ont été développés à la fin des années 1940, mais ont échoué dans les essais cliniques. Considéré comme une cible idéale, le TSA56 unique lui-même est très variable dans sa composition chimique dans différentes souches. Un vaccin efficace contre une souche n'est pas utile pour une autre. Un vaccin idéal doit protéger toutes les souches présentes localement. Cette complexité rend difficile la production d'un vaccin utilisable. Un vaccin ciblant la protéine de la membrane externe (OMP) de 47 kDa est un candidat prometteur avec un succès expérimental chez la souris contre la souche Boryong. Le ciblage combiné de TSA56 et de ScaA est également un bon candidat pour une infection à souches mixtes.
Immunité
Il n'y a pas d'immunité durable contre l' infection à O. tsutsugamushi . La variation antigénique empêche le développement d'une immunité croisée contre les différentes souches d' O . tsutsugamushi . Un individu infecté peut développer une immunité à court terme mais qui disparaît au bout de quelques mois, et l'immunité contre une souche ne confère pas d'immunité à une autre. Une expérience d'immunisation a été réalisée en 1950 au cours de laquelle 16 volontaires ont encore développé l'infection après 11 à 25 mois d'infection primaire. On sait maintenant que la longévité de l'immunité dépend des souches de la bactérie. Lorsque la réinfection se produit avec la même souche que l'infection précédente, il peut y avoir une immunité pendant 5 à 6 ans chez les singes. Mais chez l'homme, l'immunité décline au bout d'un an et disparaît en deux ans.
Les références
![]() Cet article a été soumis à WikiJournal of Medicine pour un examen externe par des pairs universitaires en 2018 ( rapports des examinateurs ). Le contenu mis à jour a été réintégré dans la page Wikipédia sous une licence CC-BY-SA-3.0 ( 2019 ). La version du dossier examinée est :
Kholhring Lalchhandama ; et al. (13 septembre 2019). "Orientia tsutsugamushi, l'agent du typhus des broussailles". WikiJournal de médecine . 6 (1) : 4. doi : 10.15347/WJM/190.004 . ISSN 2002-4436 . Wikidata Q73054107 .
Cet article a été soumis à WikiJournal of Medicine pour un examen externe par des pairs universitaires en 2018 ( rapports des examinateurs ). Le contenu mis à jour a été réintégré dans la page Wikipédia sous une licence CC-BY-SA-3.0 ( 2019 ). La version du dossier examinée est :
Kholhring Lalchhandama ; et al. (13 septembre 2019). "Orientia tsutsugamushi, l'agent du typhus des broussailles". WikiJournal de médecine . 6 (1) : 4. doi : 10.15347/WJM/190.004 . ISSN 2002-4436 . Wikidata Q73054107 .