Déshalogénation réductrice des halo cétones - Reductive dehalogenation of halo ketones
En chimie organique , les α-halogénocétones peuvent être réduites avec la perte de l' atome d' halogène pour former des énolates . Les a-halogénocétones sont facilement préparées à partir de cétones par diverses réactions d' halogénation de cétones , et les produits sont des intermédiaires réactifs qui peuvent être utilisés pour une variété d'autres réactions chimiques .
introduction
La réduction des α-halogénocétones génère une variété de structures de produits qui peuvent présenter des modèles de substitution et une réactivité uniques. Par exemple, la réduction des α, α'-dihalo cétones conduit à des complexes métalliques 2-oxyallyle, qui participent aux réactions de cycloaddition [4 + 3] et [3 + 2] en tant que composant 2π. Les intermédiaires métalliques 2-oxyallyliques peuvent également intercepter les nucléophiles dans un processus qui implique une poussée au carbone α. De plus, du fait que la réduction des monohalogénocétones produit des énolates de manière spécifique au site, les réactions associées aux énolates ( alkylation , aldol , Michael ) peuvent être effectuées en utilisant des substrats halogénocétones dans des conditions réductrices.
(1)
Mécanisme
De nombreux agents réducteurs utilisés dans ce type de réaction sont disponibles dans le commerce. Quelques-uns nécessitent une préparation et une utilisation immédiate, notamment le couple zinc-cuivre et les couples zinc / argent. et organocuprates
Monohalo cétones
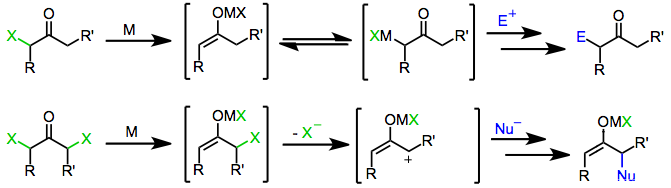
Les monohalo cétones sont réduites à la fois par des agents réducteurs à un et à deux électrons pour donner les cétones mères, des dérivés fonctionnalisés avec des électrophiles ou des produits de dimérisation . Le mécanisme de réduction lui-même dépend de la nature de l'agent réducteur.
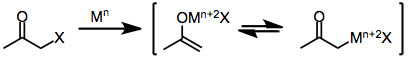
Les agents réducteurs à un électron, tels que les complexes de métal de transition d 6 ou d 1 , donnent initialement un seul électron à l'halogénocétone. La fragmentation de l' anion radical résultant produit un radical organique et un anion halogénure. Le don d'un deuxième électron à partir d'un deuxième équivalent d'agent réducteur conduit à la formation d'un énolate métallique dans lequel l' état d'oxydation de l'agent réducteur a augmenté de un.
(2)

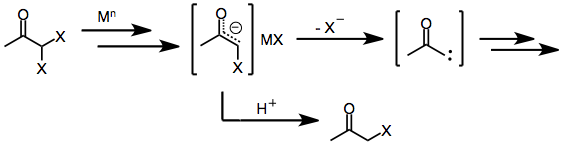
Les agents réducteurs à deux électrons , dont le plus important est le zinc métallique, subissent une addition oxydante directe aux monohalogénocétones pour donner des énolates métalliques dans lesquels l'état d'oxydation du métal a augmenté de deux. Une disproportionation ultérieure avec une halogénocétone n'ayant pas réagi conduit parfois à la formation de deux équivalents de radical énol, qui peuvent ensuite se dimériser.
(3)
Le traitement d'énolates dérivés d'agents réducteurs à un ou deux électrons avec un électrophile donne des cétones a-fonctionnalisées en tant que produit final.
α, α-dihalo cétones
Des cétones similaires à monohalogénés, géminé dihalo cétones former initialement des énolates de métaux lors d'une exposition à des agents réducteurs à un ou deux électrons. En présence d'un solvant protique , la réduction s'arrête à ce stade pour donner la monohalogénocétone (qui peut être davantage réduite en cétone mère). Cependant, en l'absence d'un solvant électrophile ou protique piégeant, la perte de l'halogénure restant de l'intermédiaire énolate donne des a-céto-carbènes ou des carbénoïdes, qui subissent des réactions d'insertion CH.
(4)
α, α'-dihalo cétones
La réduction initiale des a, a'-dihalo cétones conduit à des intermédiaires d'énolates métalliques. La perte de l'halogénure restant génère des complexes métalliques 2-oxyallyle, qui subissent des réactions de cycloaddition [4 + 3] et [3 + 2] en présence de diènes ou d'oléfines. L'isomérisation des complexes métalliques 2-oxyallyle en cyclopropanone et sous forme d' oxyde d'allène est rapide et réversible; l'augmentation du caractère covalent de la liaison oxygène-métal favorise l'isomère 2-oxyallyle.
(5)

Portée et limites
Les réductions des a-halogénocétones peuvent fournir les cétones mères, les halogénocétones partiellement réduites ou les produits résultant de l'interception d'intermédiaires le long de la voie de réduction avec des nucléophiles ou des électrophiles. Les produits obtenus dépendent à la fois de l'agent réducteur et du schéma de substitution de l'halogénocétone.
Monohalo cétones
Les monohalo cétones peuvent être réduites en la cétone mère correspondante avec du lithium métallique, suivie d'une protonation de l'énolate. D'autres agents réducteurs utiles pour cette transformation comprennent les dialkylcuprates de lithium et l'hexacarbonyl-alumine de molybdène.
(6)

L'alkylation des énolates générés par la réduction des monohalogénocétones est limitée aux halogénures d'alkyle les plus réactifs . Cependant, la réduction en présence d'un aldéhyde conduit à des produits d'aldol réducteurs, analogues à la réaction Reformatsky des haloesters. La poussière de zinc peut être utilisée seule; ou sous forme d' amalgame , en combinaison avec du chlorure de diéthylaluminium , ou avec des quantités catalytiques de bromure de cuivre (I) .
(sept)
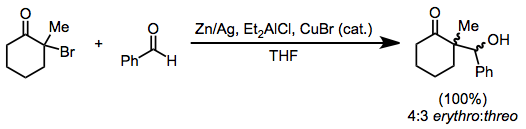
La dimérisation réductrice peut résulter de la combinaison de deux radicaux α-acyle intermédiaires ou de l'attaque nucléophile d'un énolate métallique sur une halogénocétone n'ayant pas réagi. Bien que des mélanges réactionnels complexes en résultent souvent, une dimérisation sélective est possible dans certains cas. Dans l'exemple ci-dessous, la distribution du produit dépend du solvant
(8)

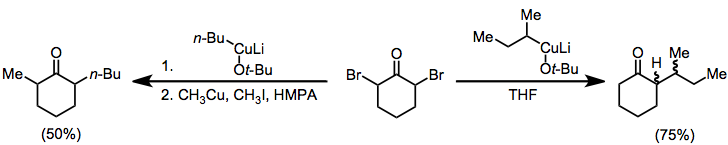
α, α-dihalo cétones
Selon les conditions employées, les dihalo cétones géminales peuvent être réduites en cétone mère, en monohalogénocétone ou en monohalogénocétone fonctionnalisée avec des organocuprates . Le réchauffement des α-halogénocétones fonctionnalisées produites dans ces conditions de -40 ° C à la température ambiante conduit à la cétone α, β-insaturée correspondante.
(9)

α, α'-dihalo cétones
Les organocuprates peuvent également être utilisés pour la réduction des a, a'-dihalo cétones en cétones alkylées. En l'absence d'électrophile, la monoalkyl cétone est isolée avec un bon rendement; lorsqu'un iodure d'alkyle est ajouté, la dialkylcétone est isolée (l'alkylation géminée est une réaction secondaire problématique).
(dix)
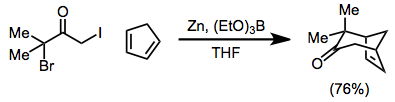
Les intermédiaires métalliques 2-oxyallyle générés lors des réductions des α, α'-dihalo cétones avec des complexes de fer (0) participent aux réactions de cycloaddition [4 + 3] et [3 + 2] pour former respectivement des cyclohepténones et des cyclopentanones. Au cours des réactions de cycloaddition [3 + 2], le substituant sur l' alcène peut être éliminé pour fournir des cyclopenténones à partir d'alcènes dans un pot.
(11)

La portée des cycloadditions [4 + 3] est large - la réaction peut être utilisée pour former des cyclohepténones, ainsi que des produits polycycliques pontés ou condensés. La réduction peut être effectuée en présence du composant 4π
(12)
Applications synthétiques
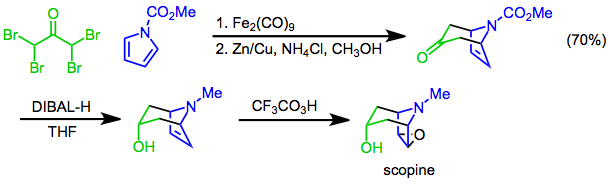
Des [4 + 3] cycloadditions de pyrroles peuvent être utilisées pour établir le squelette bicyclique des alcaloïdes tropaniques . Par exemple, une synthèse de scopine utilise la [4 + 3] cycloaddition de N- méthoxycarbonylpyrrole et de α, α, α ', α'-tétrabromoacétone comme étape clé. La réduction diastéréosélective avec de l'hydrure de diisobutylaluminium (DIBAL-H) suivie d'une époxydation avec de l'acide trifluoropéracétique fournit la cible.
(13)