Réaction de Shapiro - Shapiro reaction
La réaction de Shapiro ou décomposition de la tosylhydrazone est une réaction organique dans laquelle une cétone ou un aldéhyde est converti en un alcène via une hydrazone intermédiaire en présence de 2 équivalents de réactif organolithien . La réaction a été découverte par Robert H. Shapiro en 1967. La réaction de Shapiro a été utilisée dans la synthèse totale de Nicolaou Taxol . Cette réaction est très similaire à la réaction de Bamford-Stevens , qui implique également la décomposition basique des tosyl hydrazones.
Mécanisme de réaction
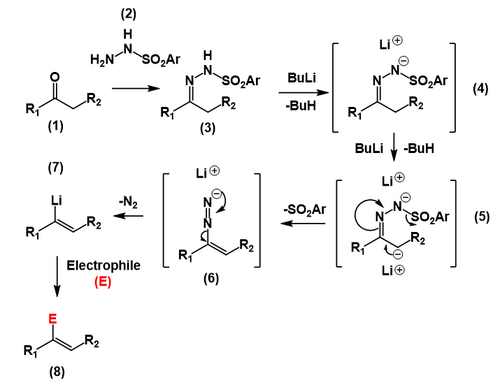
En prélude à la réaction de Shapiro proprement dite, une cétone ou un aldéhyde (1) est mis à réagir avec du p- toluènesulfonylhydrazide (2) pour former une p- toluènesulfonylhydrazone (ou tosylhydrazone ) qui est une hydrazone (3) . Deux équivalents de base forte comme le n- butyllithium extraient le proton de l'hydrazone (4) suivi du proton moins acide au carbone de l'hydrazone (5) , formant un carbanion . Le carbanion subit alors une réaction d'élimination produisant une double liaison carbone-carbone et éjectant l' anion tosyle , formant un anion diazonium (6) . Cet anion diazonium est ensuite perdu sous forme d'azote moléculaire résultant en une espèce vinyllithium (7) , qui peut ensuite être mise à réagir avec divers électrophiles , y compris une simple neutralisation avec de l'eau ou un acide (8) .
Portée
La position de l'alcène dans le produit est contrôlée par le site de déprotonation par la base organolithienne. En général, le site cinétiquement favorisé et moins substitué des tosylhydrazones différentiellement substituées est déprotoné sélectivement, conduisant à l' intermédiaire vinyllithium moins substitué . Bien que de nombreuses réactions secondaires existent pour le groupe fonctionnel vinyllithium , dans la réaction de Shapiro en particulier de l' eau est ajoutée, ce qui entraîne la protonation de l' alcène . D'autres réactions des composés vinyllithium comprennent des réactions d'alkylation avec par exemple des halogénures d'alkyle .

Il est important de noter que la réaction de Shapiro ne peut pas être utilisée pour synthétiser des 1-lithioalcènes (et les dérivés fonctionnalisés résultants), car les sulfonylhydrazones dérivées d'aldéhydes subissent une addition exclusive de la base organolithique au carbone de la double liaison C-N.
Réaction catalytique de Shapiro
Les réactions Shapiro traditionnelles nécessitent des quantités stoechiométriques (parfois en excès) de base pour générer les réactifs alcényllithium. Pour lutter contre ce problème, Yamamoto et ses collègues ont développé une voie stéréosélective et régiosélective efficace vers les alcènes en utilisant une combinaison de cétone phénylaziridinylhydrazones comme équivalents d'arènesulfonylhydrazone avec une quantité catalytique d'amides de lithium. La phénylaziridinylhydrazone requise a été préparée à partir de la condensation d'undécan-6-one avec la 1-amino-2-phénylaziridine. Le traitement de la phénylaziridinylhydrazone avec 0,3 équivalent de LDA dans l'éther a donné l'alcène indiqué ci-dessous avec un rapport cis : trans de 99,4:0,6. Le rapport a été déterminé par analyse GLC capillaire après conversion en les époxydes correspondants avec mCPBA. La charge de catalyseur peut être réduite à 0,05 équivalent dans le cas d'une réaction à l'échelle de 30 mmol.
La haute stéréosélectivité est obtenue par l'abstraction préférentielle de l'hydrogène -méthylène syn à la phénylaziridine, et est également expliquée par la chélation interne de l'intermédiaire lithié.
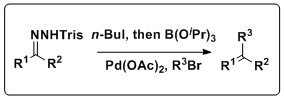
Une réaction Shapiro-Suzuki combinée in situ en un seul pot
La réaction de Shapiro peut également être combinée avec la réaction de Suzuki pour produire une variété de produits oléfiniques. Keay et ses collègues ont développé une méthodologie qui combine ces réactions dans un processus unique qui ne nécessite pas l'isolement de l' acide boronique , un revers du couplage Suzuki traditionnel. Cette réaction a une large portée, tolérant une multitude de trisylhydrazones et d'halogénures d'aryle, ainsi que plusieurs solvants et sources de Pd.
Une application de la réaction de Shapiro en synthèse totale
La réaction de Shapiro a été utilisée pour générer des oléfines vers des produits naturels complexes. K. Mori et ses collaborateurs ont voulu déterminer la configuration absolue du groupe phytocassane d'une classe de produits naturels appelés phytoalexines . Ceci a été accompli en préparant le (–)-phytocassane D d'origine naturelle à partir de ( R ) -Wieland -Miescher cétone . Sur le chemin du (–)-phytocassane D, une cétone tricyclique a été soumise à des conditions de réaction de Shapiro pour donner le produit alcène cyclique.