Syndrome de Wiskott-Aldrich - Wiskott–Aldrich syndrome
| Syndrome de Wiskott-Aldrich | |
|---|---|
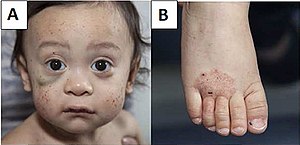 | |
| A) Des pétéchies multiples et un hématome sous l'œil droit (à gauche sur l'image). B) Eczéma du pied. | |
| Spécialité |
Immunologie |
Le syndrome de Wiskott-Aldrich ( WAS ) est une maladie rare récessive liée à l'X caractérisée par un eczéma , une thrombocytopénie (faible numération plaquettaire ), un déficit immunitaire et une diarrhée sanglante (secondaire à la thrombocytopénie). Il est aussi parfois appelé syndrome d'eczéma-thrombocytopénie-immunodéficience conformément à la description originale d'Aldrich en 1954. Les troubles liés au WAS de la thrombocytopénie liée à l'X (XLT) et de la neutropénie congénitale liée à l'X (XLN) peuvent présenter symptômes et sont causés par des mutations du même gène.
Signes et symptômes
Le WAS survient le plus souvent chez les hommes en raison de son mode de transmission récessif lié à l'X, affectant entre 1 et 10 hommes par million. Les premiers signes sont généralement des pétéchies et des ecchymoses, résultant d'une faible numération plaquettaire (c'est-à-dire une thrombocytopénie ). Les saignements de nez spontanés et la diarrhée sanglante sont également fréquents et l' eczéma se développe généralement au cours du premier mois de vie. Les infections bactériennes récurrentes se développent généralement vers l'âge de trois mois. La majorité des enfants atteints du WAS développent au moins une maladie auto-immune et des cancers (principalement des lymphomes et des leucémies ) se développent chez jusqu'à un tiers des patients. Les taux d' immunoglobuline M (IgM) sont réduits, les taux d' IgA et d' IgE sont élevés et les taux d' IgG peuvent être normaux, réduits ou élevés. En plus de la thrombocytopénie, les patients atteints du WAS ont des plaquettes anormalement petites (c'est-à-dire des microthrombocytes) et environ 30 % ont également un nombre élevé d' éosinophiles (c'est-à-dire une éosinophilie ).
Physiopathologie
Les microthrombocytes observés chez les patients atteints du WAS n'ont été observés que dans une autre affection, le déficit en ARPC1B . Dans les deux cas, on pense que les plaquettes défectueuses sont retirées de la circulation par la rate et/ou le foie, ce qui entraîne une faible numération plaquettaire. Les patients atteints du WAS ont une susceptibilité accrue aux infections, en particulier des oreilles et des sinus, et ce déficit immunitaire a été lié à une diminution de la production d' anticorps et à l'incapacité des cellules T immunitaires à lutter efficacement contre l'infection.
La génétique

WAS est associé à des mutations dans un gène sur le bras court du chromosome X (Xp11.23) qui était à l'origine appelé le gène de la protéine du syndrome de Wiskott-Aldrich et est officiellement connu sous le nom de WAS (Gene ID: 7454). La thrombocytopénie liée à l'X (XLT) est également liée à des variantes pathogènes du gène WAS , bien que certaines variantes aient tendance à être plus fortement associées à XLT que d'autres qui sont davantage associées à WAS. La neutropénie liée à l'X, une maladie rare, a également été liée à un sous-ensemble spécifique de mutations WAS .
Le produit protéique de WAS est connu sous le nom de WASp. Il contient 502 acides aminés et est principalement exprimé dans les cellules hématopoïétiques (les cellules de la moelle osseuse qui se développent en cellules sanguines). La fonction principale de WASp est d'activer la polymérisation de l'actine en servant de facteur favorisant la nucléation (NPF) pour le complexe Arp2/3 , qui génère des filaments d'actine ramifiés. Plusieurs protéines peuvent servir de NPF, et il a été observé que dans les plaquettes WAS, le complexe Arp2/3 fonctionne normalement, indiquant que WASp n'est pas requis pour son activation dans les plaquettes. Dans les lymphocytes T, le WASp est important car il est connu pour être activé via les voies de signalisation des récepteurs des lymphocytes T pour induire des réarrangements du cytosquelette d' actine corticale qui sont responsables de la formation de la synapse immunologique .
La sévérité des symptômes produits par les variantes pathogènes du gène WAS est généralement en corrélation avec leurs effets sur le WASp. Les variantes faux-sens sont généralement associées à une maladie moins grave que les variantes tronquées qui ne produisent aucune protéine en raison d'une carie induite par le non-sens . Cependant, cette corrélation n'est pas parfaite, et parfois la même variante peut être observée à la fois dans XLT et dans WAS (parfois au sein de deux membres différents de la même famille), un concept en génétique appelé expressivité variable . Bien qu'une maladie auto-immune et une malignité puissent survenir dans les deux cas, les patients présentant une perte de WASp sont plus à risque. Un défaut de la molécule CD43 a également été trouvé chez les patients atteints du WAS.
Diagnostic
Le diagnostic peut être posé sur la base des résultats cliniques, du frottis sanguin périphérique et des faibles taux d' immunoglobulines . Typiquement, les taux d'IgM sont bas, les taux d'IgA sont élevés et les taux d'IgE peuvent être élevés ; des paraprotéines sont parfois observées. Les tests immunologiques cutanés (tests d'allergie) peuvent révéler une hyposensibilité. Les personnes atteintes du syndrome de Wiskott-Aldrich sont cependant plus à risque d'allergies alimentaires graves. Tous les patients n'ont pas d'antécédents familiaux positifs de la maladie ; de nouvelles mutations se produisent. Souvent, une leucémie peut être suspectée sur la base d'un faible nombre de plaquettes et d'infections, et une biopsie de la moelle osseuse peut être réalisée. Des niveaux réduits de WASp sont généralement observés. L'étalon-or actuel pour le diagnostic est l'analyse de séquence d'ADN , qui peut détecter le WAS et les troubles associés XLT et XLN chez 95 % des patients et des porteurs.
| Critères obligatoires |
|
| Définitive |
|
| Probable |
|
| Possible |
|
Classification
Jin et al. (2004) utilisent un classement numérique de la gravité : ce score, qui va de 0 à 5, peut avoir une utilité clinique pour prédire la gravité de la maladie. Ceux qui ont des scores WAS plus élevés (par exemple, 5) à des âges plus jeunes (par exemple, moins de 5 ans), sont considérés comme les plus à risque de morbidité et de mortalité accrues liées à leur état. Comme les individus peuvent développer plus de symptômes liés au WAS (par exemple, maladie auto-immune, tumeur maligne) avec l'âge, le score WAS peut augmenter avec le temps. Un score WAS inférieur peut être plus compatible avec une prise en charge conservatrice par rapport à des scores WAS plus élevés qui peuvent favoriser une intervention avec des traitements tels que la greffe de cellules souches hématopoïétiques .
| But | Définition | Syndrome clinique |
|---|---|---|
| 0 | Neutropénie (faible nombre de globules blancs) ou myélodysplasie uniquement | Neutropénie liée à l'X (XLN) |
| 0,5 | Thrombocytopénie intermittente (faible numération plaquettaire parfois mais pas toujours) | Thrombocytopénie liée à l'X (XLT) |
| 1 | Thrombocytopénie et petites plaquettes (microthrombocytopénie) | XLT |
| 2 | Microthrombocytopénie plus eczéma normalement réactif ou infections occasionnelles des voies respiratoires supérieures | XLT |
| 2.5 | Microthrombocytopénie plus eczéma ou infections des voies respiratoires répondant au traitement mais sévères nécessitant des antibiotiques | XLT/syndrome de Wiskott-Aldrich (WAS) |
| 3 | Microthrombocytopénie plus eczéma et infections des voies respiratoires nécessitant des antibiotiques | ÉTAIT |
| 4 | Microthrombocytopénie plus eczéma nécessitant un traitement continu et/ou infections sévères ou potentiellement mortelles | ÉTAIT |
| 5 | Microthrombocytopénie plus maladie auto-immune ou malignité | XLT/WAS + maladie auto-immune ou cancer |
Traitement
Greffe de cellules souches hématopoïétiques
Le traitement du syndrome de Wiskott-Aldrich dépend de la gravité de la maladie. Le WAS est principalement un trouble des tissus hématopoïétiques, donc en cas de maladie grave (WAS score 3-5), le seul traitement curatif largement disponible actuellement disponible est une greffe de cellules souches hématopoïétiques (HCT). Dans cette procédure, les cellules souches sont récoltées à partir du sang du cordon ombilical , de la moelle osseuse ou du sang périphérique après un traitement avec des médicaments qui provoquent la sortie des cellules souches de la moelle osseuse et leur circulation systémique. Les meilleurs résultats sont obtenus avec des donneurs HLA identiques ou similaires (souvent des frères et sœurs). Dans les cas de maladie moins grave, les avantages potentiels de la HCT (> 90 % de probabilité de guérison si la greffe survient avant l'âge de deux ans) doivent être pris en compte dans le contexte des risques non négligeables présentés par la procédure elle-même et du besoin potentiel d'une immunosuppression à vie pour prévenir la greffe. maladie contre l'hôte . En général, les résultats sont meilleurs si la HCT survient avant le développement d' une maladie auto-immune ou d'une tumeur maligne , mais il existe des risques associés à la chimiothérapie (nécessaire pour faire de la place aux nouvelles cellules souches), en particulier chez les jeunes nourrissons (risque d'un second cancer ou d' infertilité ).
Complications hémorragiques
Sinon, le traitement WAS est axé sur la gestion des symptômes et la prévention des complications. Le plus grand risque de mortalité dans le WAS avant l'âge de 30 ans est dû aux saignements. Par conséquent, l' aspirine et d'autres médicaments anti-inflammatoires non stéroïdiens qui peuvent interférer avec la fonction plaquettaire déjà compromise doivent généralement être évités. La circoncision , ainsi que les chirurgies électives, doivent généralement être différées chez les hommes atteints de thrombocytopénie jusqu'à la fin de la HCT si possible. Les casques de protection peuvent aider à protéger les enfants contre une hémorragie intracrânienne potentiellement mortelle (saignement cérébral) qui pourrait résulter de traumatismes crâniens. Les patients peuvent avoir besoin de transfusions de plaquettes lorsqu'il y a une perte de sang extrême (comme pendant une intervention chirurgicale) ou pour une splénectomie plaquettaire très basse (ablation de la rate) peut également sauver des vies. Cependant, la splénectomie est généralement considérée comme palliative et n'est pas universellement recommandée dans le WAS car elle peut augmenter le risque d'infections potentiellement mortelles. Les patients post-splénectomie auront besoin d'une prophylaxie antibiotique à vie pour prévenir les infections. L'étude d' eltrombopag , un agent thrombopoïétique utilisé pour augmenter le nombre de plaquettes dans le purpura thrombocytopénique immunitaire (ITP), dans le WAS a conclu que bien qu'il augmente le nombre de plaquettes, il n'a pas réussi à augmenter l'activation plaquettaire chez la plupart des patients. Il a depuis été proposé que l'eltrombopag puisse être utilisé pour établir un pont vers la HCT chez les patients atteints de thrombocytopénie sévère afin de normaliser le nombre de plaquettes sans transfusion et de réduire les événements hémorragiques. L'anémie due à des saignements peut nécessiter une supplémentation en fer ou une transfusion sanguine . Une surveillance régulière de la numération globulaire est recommandée.
Infections et maladies auto-immunes
Pour les patients présentant des infections fréquentes, des immunoglobulines intraveineuses (IVIG) ou des immunoglobulines sous - cutanées peuvent être régulièrement programmées pour renforcer le système immunitaire. L'adéquation du remplacement des IgIV peut être évaluée via des tirages périodiques en laboratoire. WAS patients présentant une atteinte du système immunitaire peuvent bénéficier d' une prophylaxie antibiotique , par exemple en prenant triméthoprime-sulfaméthoxazole pour prévenir Pneumocystis de pneumonie concernant la PI . De même, l'utilisation prophylactique d'antibiotiques peut également être envisagée chez les patients présentant des infections bactériennes récurrentes des sinus ou des poumons . Lorsqu'il y a des signes ou des symptômes d'une infection, une évaluation rapide et approfondie est importante, y compris des hémocultures pour guider le traitement (souvent des antibiotiques IV). Les vaccins vivants (tels que le ROR ou le rotavirus ) doivent être évités lors de la vaccination systématique des enfants. Les vaccins inactivés peuvent être administrés en toute sécurité mais peuvent ne pas fournir des niveaux protecteurs d'immunité. L'eczéma est généralement traité avec des stéroïdes topiques , et si les infections cutanées chroniques aggravent l'eczéma, un antibiotique peut également être administré. Les maladies auto-immunes sont gérées avec l'utilisation judicieuse d'immunosuppresseurs appropriés.
Thérapie génique
Pour les hommes gravement atteints sans donneur compatible HLA, des études de correction du syndrome de Wiskott-Aldrich par thérapie génique utilisant un lentivirus sont en cours. La preuve du principe d'une thérapie génique réussie par cellules souches hématopoïétiques a été fournie pour les patients atteints du syndrome de Wiskott-Aldrich. En juillet 2013, l'Institut italien du téléthon de San Raffaele pour la thérapie génique (HSR-TIGET) a signalé que trois enfants atteints du syndrome de Wiskott-Aldrich présentaient une amélioration significative (amélioration du nombre de plaquettes, de la fonction immunitaire et des symptômes cliniques) 20 à 30 mois après avoir été traités avec un lentivirus génétiquement modifié. En avril 2015, les résultats d'un essai de suivi britannique et français de six individus sur sept ont montré une amélioration de la fonction immunitaire et des symptômes cliniques en moyenne 27 mois après le traitement par thérapie génique. Il est important de noter qu'aucune des deux études n'a mis en évidence de prolifération leucémique après le traitement, une complication des premières tentatives de thérapie génique utilisant un vecteur rétroviral. On ne sait pas pourquoi ces thérapies géniques n'ont pas rétabli le nombre normal de plaquettes, mais le traitement par thérapie génique était toujours associé à l'indépendance transfusionnelle et à une réduction significative des événements hémorragiques. Une version de ce traitement, l' OTL-103 , est en cours de développement par Orchard Therapeutics et (au 28 juin 2021) fait l'objet d'essais cliniques de Phase I/II .
Pronostic
Les résultats du syndrome de Wiskott-Aldrich sont variables et dépendent de la gravité de la maladie (le score WAS peut être utilisé pour évaluer la gravité de la maladie). L'extrémité la plus bénigne du spectre de la maladie associée au gène WAS est appelée neutropénie liée à l' X ou thrombocytopénie liée à l'X , et cette dernière aurait une espérance de vie normale avec des rapports d'hommes peu touchés survivant dans leur septième décennie sans traitement . Traditionnellement, cependant, le syndrome de Wiskott-Aldrich a été associé à une mort prématurée due à des causes telles que des saignements, des infections ou une malignité. Le syndrome de Wiskott-Aldrich est une affection à expressivité variable , ce qui signifie que même au sein d'une même famille, certains peuvent ne présenter qu'une thrombocytopénie chronique tandis que d'autres présentent des complications graves et potentiellement mortelles du syndrome de Wiskott-Aldrich pendant la petite enfance ou l'enfance. Étant donné que les symptômes évoluent souvent avec l'âge, il est difficile de prédire à quel point un nourrisson nouvellement diagnostiqué sera éventuellement affecté. Il existe une certaine corrélation génotype-phénotype, la plupart des individus atteints de thrombocytopénie liée à l'X ayant des variantes faux-sens du gène WAS contre 86,5% de ceux qui ne produisent pas de protéine WAS ayant le phénotype classique du syndrome de Wiskott-Aldrich. Dans l'ensemble, le pronostic des personnes atteintes du syndrome de Wiskott-Aldrich s'est considérablement amélioré au cours des dernières décennies en raison de diagnostics plus précoces et d'un meilleur accès aux traitements.
Épidémiologie
L'incidence estimée du syndrome de Wiskott-Aldrich aux États-Unis est d'un sur 250 000 naissances masculines vivantes. Bien qu'il s'agisse encore d'une maladie rare, cela la rend plus fréquente que de nombreux syndromes d'immunodéficience génétique tels que le syndrome d' hyper-IgM ou SCID , qui ont une incidence estimée à environ une naissance vivante sur 1 000 000, et le syndrome de Wiskott-Aldrich représenterait 1,2 %. de toutes les immunodéficiences héréditaires aux États-Unis. WAS se produit dans le monde entier et n'est pas connu pour être plus fréquent dans un groupe ethnique particulier.
Histoire
Le syndrome porte le nom du Dr Alfred Wiskott (1898-1978), un pédiatre allemand qui a remarqué le syndrome pour la première fois en 1937, et du Dr Robert Anderson Aldrich (1917-1998), un pédiatre américain qui a décrit la maladie dans une famille de Néerlandais. -Américains en 1954. Wiskott a décrit trois frères atteints d'une maladie similaire, dont les sœurs n'étaient pas affectées. En 2006, un groupe de recherche allemand a analysé les membres de la famille des trois cas de Wiskott et a supposé qu'ils partageaient probablement une nouvelle mutation de décalage du cadre de lecture du premier exon du gène WASp .
Les références
Lectures complémentaires
- Entrée GeneReviews/NIH/NCBI/UW sur les troubles liés au WAS, y compris le syndrome de Wiskott-Aldrich Thrombocytopénie liée à l'X WAS XLT et neutropénie congénitale liée à l'X XLN
- Immune Deficiency Foundation - Chapitre VII, "Le syndrome de Wiskott-Aldrich"
- Fondation Wiskott-Aldrich
Liens externes
| Classification | |
|---|---|
| Ressources externes |
