Profil énergétique (chimie) - Energy profile (chemistry)
Pour une réaction ou un processus chimique, un profil énergétique (ou diagramme de coordonnées de réaction ) est une représentation théorique d'une seule voie énergétique, le long de la coordonnée de réaction, lorsque les réactifs sont transformés en produits. Les diagrammes de coordonnées de réaction sont dérivés de la surface d'énergie potentielle (PES) correspondante, qui sont utilisées en chimie computationnelle pour modéliser les réactions chimiques en reliant l'énergie d'une ou plusieurs molécules à sa structure (dans l' approximation de Born-Oppenheimer ). La coordonnée de réaction est une courbe paramétrique qui suit le chemin d'une réaction et indique la progression d'une réaction.
Qualitativement, les diagrammes de coordonnées de réaction (surfaces d'énergie unidimensionnelles) ont de nombreuses applications. Les chimistes utilisent les diagrammes de coordonnées de réaction comme une aide à la fois analytique et pédagogique pour rationaliser et illustrer les événements cinétiques et thermodynamiques . Le but des profils d'énergie et des surfaces est de fournir une représentation qualitative de la façon dont l'énergie potentielle varie avec le mouvement moléculaire pour une réaction ou un processus donné.
Surfaces d'énergie potentielle
En termes plus simples, une surface d'énergie potentielle ou PES est une représentation mathématique ou graphique de la relation entre l'énergie d'une molécule et sa géométrie. Les méthodes de description de l'énergie potentielle se décomposent en une interprétation classique de la mécanique ( mécanique moléculaire ) et une interprétation de la mécanique quantique . Dans l'interprétation de la mécanique quantique, une expression exacte de l'énergie peut être obtenue pour toute molécule dérivée des principes quantiques (bien qu'un ensemble de bases infinies puisse être requis), mais les calculs / méthodes ab initio utiliseront souvent des approximations pour réduire le coût de calcul. La mécanique moléculaire est empiriquement basée et l'énergie potentielle est décrite comme une fonction de termes composants qui correspondent à des fonctions potentielles individuelles telles que la torsion , les étirements, les courbes, les énergies de Van der Waals , l'électrostatique et les termes croisés. Chaque fonction potentielle de composant est adaptée aux données expérimentales ou aux propriétés prédites par des calculs ab initio. La mécanique moléculaire est utile pour prédire les géométries d'équilibre et les états de transition ainsi que la stabilité conformationnelle relative. Au fur et à mesure qu'une réaction se produit, les atomes des molécules impliquées subissent généralement un certain changement d'orientation spatiale par le mouvement interne ainsi que par son environnement électronique. Les distorsions des paramètres géométriques entraînent un écart par rapport à la géométrie d'équilibre (minima d'énergie locaux). Ces changements de géométrie d'une molécule ou interactions entre molécules sont des processus dynamiques qui nécessitent de comprendre toutes les forces opérant au sein du système. Puisque ces forces peuvent être dérivées mathématiquement en tant que première dérivée de l'énergie potentielle par rapport à un déplacement, il est logique de cartographier l'énergie potentielle E du système en fonction des paramètres géométriques q 1 , q 2 , q 3 et ainsi de suite. L'énergie potentielle à des valeurs données des paramètres géométriques (q 1 , q 2 ,…, q n ) est représentée comme une hyper-surface (lorsque n> 2 ou une surface lorsque n ≤ 2). Mathématiquement, il peut être écrit comme-
E = f (q 1 , q 2 ,…, q n )
Pour l'interprétation de la mécanique quantique, un PES est généralement défini dans l'approximation de Born-Oppenheimer (afin de distinguer entre le mouvement et l'énergie nucléaires et électroniques) qui déclare que les noyaux sont stationnaires par rapport aux électrons. En d'autres termes, l'approximation permet de négliger l'énergie cinétique des noyaux (ou le mouvement des noyaux) et donc la répulsion des noyaux est une valeur constante (en tant que charges ponctuelles statiques) et n'est prise en compte que lors du calcul de l'énergie totale du système . L'énergie électronique est alors considérée comme dépendant paramétriquement des coordonnées nucléaires, ce qui signifie qu'une nouvelle énergie électronique (E e ) doit être calculée pour chaque configuration atomique correspondante. Le PES est un concept important en chimie computationnelle et facilite grandement l'optimisation de la géométrie et des états de transition.
Degrés de liberté
Un système à N-atomes est défini par 3N coordonnées - x, y, z pour chaque atome. Ces 3N degrés de liberté peuvent être décomposés pour inclure 3 degrés de liberté de translation globale et 3 (ou 2) degrés de liberté de rotation globaux pour un système non linéaire (pour un système linéaire). Cependant, les degrés globaux de translation ou de rotation n'affectent pas l'énergie potentielle du système, qui ne dépend que de ses coordonnées internes. Ainsi, un système à N-atomes sera défini par des coordonnées 3N-6 (non linéaires) ou 3N-5 (linéaires). Ces coordonnées internes peuvent être représentées par de simples coordonnées d'étirement, de flexion, de torsion, ou des combinaisons linéaires adaptées à la symétrie, ou des coordonnées redondantes, ou des coordonnées de modes normaux, etc. Pour un système décrit par des coordonnées internes N, une fonction d'énergie potentielle distincte peut être écrite par rapport à chacune de ces coordonnées en maintenant les autres paramètres (N-1) à une valeur constante permettant de surveiller la contribution d'énergie potentielle d'un mouvement moléculaire particulier (ou d'une interaction) tandis que les autres paramètres (N-1) sont définis.
Considérons une molécule diatomique AB qui peut être visualisée macroscopiquement comme deux boules (qui représentent les deux atomes A et B) reliées par un ressort qui représente la liaison. Au fur et à mesure que ce ressort (ou liaison) est étiré ou comprimé, l'énergie potentielle du système à billes (molécule AB) change et cela peut être cartographié sur un tracé bidimensionnel en fonction de la distance entre A et B, c'est-à-dire la longueur de la liaison. .
Le concept peut être étendu à une molécule tri-atomique telle que l'eau où nous avons deux liaisons OH et un angle de liaison HOH comme variables dont dépendra l'énergie potentielle d'une molécule d'eau. Nous pouvons supposer en toute sécurité que les deux liaisons OH sont égales. Ainsi, un PES peut être dessiné en cartographiant l'énergie potentielle E d'une molécule d'eau en fonction de deux paramètres géométriques, q 1 = longueur de liaison OH et q 2 = angle de liaison HOH. Le point le plus bas d'un tel PES définira la structure d'équilibre d'une molécule d'eau.
Le même concept est appliqué aux composés organiques comme l' éthane , le butane, etc. pour définir leur énergie la plus basse et les conformations les plus stables .
Caractériser un PES
Les points les plus importants sur un PES sont les points stationnaires où la surface est plane, c'est-à-dire parallèle à une ligne horizontale correspondant à un paramètre géométrique, un plan correspondant à deux de ces paramètres ou encore un hyper-plan correspondant à plus de deux paramètres géométriques. Les valeurs d'énergie correspondant aux états de transition et à l'état fondamental des réactifs et produits peuvent être trouvées à l'aide de la fonction d'énergie potentielle en calculant les points critiques de la fonction ou les points stationnaires. Les points stationnaires se produisent lorsque la première dérivée partielle de l'énergie par rapport à chaque paramètre géométrique est égale à zéro.
En utilisant des dérivées analytiques de l'expression dérivée de l'énergie,, on peut trouver et caractériser un point stationnaire comme minimum, maximum ou point de selle. Les états fondamentaux sont représentés par des minima d'énergie locaux et les états de transition par des points de selle.
Les minima représentent des espèces stables ou quasi stables, c'est-à-dire des réactifs et des produits à durée de vie finie. Mathématiquement, un point minimum est donné comme
Un point peut être un minimum local lorsqu'il est inférieur en énergie par rapport à son environnement uniquement ou un minimum global qui est le point d'énergie le plus bas sur toute la surface d'énergie potentielle.
Le point de selle représente un maximum dans une seule direction (celle de la coordonnée de réaction) et est un minimum dans toutes les autres directions. En d'autres termes, un point de selle représente un état de transition le long de la coordonnée de réaction. Mathématiquement, un point de selle se produit lorsque
pour tout q sauf le long de la coordonnée de réaction et
le long de la coordonnée de réaction.
Diagrammes de coordonnées de réaction
La coordonnée de réaction intrinsèque (IRC), dérivée de la surface d'énergie potentielle, est une courbe paramétrique qui relie deux minima d'énergie dans la direction qui traverse la barrière d'énergie minimale (ou ascension la moins profonde) passant par un ou plusieurs points de selle. Cependant, en réalité, si les espèces en réaction atteignent suffisamment d'énergie, elles peuvent s'écarter dans une certaine mesure de l'IRC. Les valeurs d'énergie (points sur l'hyper-surface) le long de la coordonnée de réaction donnent une surface d'énergie 1-D (une ligne) et, lorsqu'elles sont tracées par rapport à la coordonnée de réaction (énergie vs coordonnée de réaction), donnent ce qu'on appelle un diagramme de coordonnées de réaction (ou profil énergétique). Une autre façon de visualiser un profil d'énergie est sous la forme d'une coupe transversale de l'hyper surface, ou surface, le long de la coordonnée de réaction. La figure 5 montre un exemple de coupe transversale, représentée par le plan, prise le long de la coordonnée de réaction et l'énergie potentielle est représentée en fonction ou composite de deux variables géométriques pour former une surface d'énergie bidimensionnelle. En principe, la fonction d'énergie potentielle peut dépendre de N variables mais comme une représentation visuelle précise d'une fonction de 3 variables ou plus ne peut pas être produite (à l'exclusion des hypersurfaces de niveau ), une surface 2D a été montrée. Les points de la surface qui coupent le plan sont ensuite projetés sur le diagramme de coordonnées de réaction (illustré à droite) pour produire une tranche 1D de la surface le long de l'IRC. La coordonnée de réaction est décrite par ses paramètres, qui sont souvent donnés comme un composite de plusieurs paramètres géométriques, et peuvent changer de direction au fur et à mesure que la réaction progresse tant que la plus petite barrière d'énergie (ou énergie d'activation (Ea)) est traversée. Le point de selle représente le point d'énergie le plus élevé se trouvant sur la coordonnée de réaction reliant le réactif et le produit; c'est ce qu'on appelle l'état de transition. Un diagramme de coordonnées de réaction peut également avoir un ou plusieurs intermédiaires transitoires qui sont représentés par des puits à haute énergie connectés via un pic d'état de transition. Toute structure chimique qui dure plus longtemps que le temps des vibrations de liaison typiques (10 - 13 - 10 - 14 s) peut être considérée comme intermédiaire.
Une réaction impliquant plus d'une étape élémentaire a un ou plusieurs intermédiaires en cours de formation, ce qui signifie à son tour qu'il y a plus d'une barrière énergétique à surmonter. En d'autres termes, il y a plus d'un état de transition sur la voie de réaction. Comme il est intuitif que le fait de franchir une barrière d'énergie ou de traverser un pic d'état de transition impliquerait l'énergie la plus élevée, il devient clair que ce serait l'étape la plus lente d'une voie de réaction. Cependant, lorsque plus d'une telle barrière doit être franchie, il devient important de reconnaître la barrière la plus élevée qui déterminera la vitesse de la réaction. Cette étape de la réaction dont la vitesse détermine la vitesse globale de réaction est connue sous le nom d'étape de détermination de vitesse ou étape de limitation de vitesse. La hauteur de la barrière énergétique est toujours mesurée par rapport à l'énergie du réactif ou du matériau de départ. Différentes possibilités ont été illustrées à la figure 6.

Les diagrammes de coordonnées de réaction donnent également des informations sur l'équilibre entre un réactif ou un produit et un intermédiaire. Si l'énergie de barrière pour passer de l'intermédiaire au produit est beaucoup plus élevée que celle pour la transition du réactif à l'intermédiaire, il peut être conclu en toute sécurité qu'un équilibre complet est établi entre le réactif et l'intermédiaire. Cependant, si les deux barrières énergétiques pour la transformation réactif-intermédiaire et intermédiaire-produit sont presque égales, alors aucun équilibre complet n'est établi et l'approximation en régime permanent est invoquée pour dériver les expressions de vitesse cinétique pour une telle réaction.
Dessiner un diagramme de coordonnées de réaction
Bien qu'un diagramme de coordonnées de réaction soit essentiellement dérivé d'une surface d'énergie potentielle, il n'est pas toujours possible d'en tirer un à partir d'un PES. Un chimiste dessine un diagramme de coordonnées de réaction pour une réaction basé sur la connaissance de l'énergie libre ou du changement d'enthalpie associé à la transformation qui l'aide à mettre en perspective le réactif et le produit et à savoir si un intermédiaire est formé ou non. Une ligne directrice pour dessiner des diagrammes pour des réactions complexes est le principe du moindre mouvement qui dit qu'une réaction favorisée procédant d'un réactif à un intermédiaire ou d'un intermédiaire à un autre ou produit est celle qui a le moins de changement de position nucléaire ou de configuration électronique. Ainsi, on peut dire que les réactions impliquant des changements dramatiques de position des noyaux se produisent en fait par le biais d'une série de réactions chimiques simples. Le postulat de Hammond est un autre outil qui aide à tirer l'énergie d'un état de transition par rapport à un réactif, un intermédiaire ou un produit. Il indique que l'état de transition ressemble au réactif, à l'intermédiaire ou au produit dont il est le plus proche en énergie, tant que la différence d'énergie entre l'état de transition et la structure adjacente n'est pas trop grande. Ce postulat permet de prédire avec précision la forme d'un diagramme de coordonnées de réaction et donne également un aperçu de la structure moléculaire à l'état de transition.
Considérations cinétiques et thermodynamiques
Une réaction chimique peut être définie par deux paramètres importants: l' énergie libre de Gibbs associée à une transformation chimique et la vitesse d'une telle transformation. Ces paramètres sont indépendants les uns des autres. Alors que le changement d'énergie libre décrit la stabilité des produits par rapport aux réactifs, la vitesse de toute réaction est définie par l'énergie de l'état de transition par rapport au matériau de départ. En fonction de ces paramètres, une réaction peut être favorable ou défavorable, rapide ou lente et réversible ou irréversible, comme le montre la figure 8.
Une réaction favorable est celle dans laquelle le changement d'énergie libre ∆ G ° est négatif ( exergonique ) ou en d'autres termes, l'énergie libre du produit, G ° produit , est inférieure à l'énergie libre des matières premières, G ° réactif . ∆ G °> 0 ( endergonique ) correspond à une réaction défavorable. Le ∆ G ° peut être écrit en fonction du changement d' enthalpie (∆ H °) et du changement d' entropie (∆ S °) comme ∆ G ° = ∆ H ° - T ∆ S ° . Pratiquement, les enthalpies, et non l'énergie libre, sont utilisées pour déterminer si une réaction est favorable ou défavorable, car ∆ H ° est plus facile à mesurer et T ∆ S ° est généralement trop petit pour être significatif (pour T <100 ° C) . Une réaction avec ∆ H ° <0 est appelée réaction exothermique tandis qu'une réaction avec ∆ H °> 0 est endothermique .
La stabilité relative du réactif et du produit ne définit pas la faisabilité d'une réaction à elle seule. Pour qu'une réaction se déroule, le matériau de départ doit avoir suffisamment d'énergie pour traverser une barrière d'énergie. Cette barrière énergétique est appelée énergie d'activation (∆ G ≠ ) et la vitesse de réaction dépend de la hauteur de cette barrière. Une barrière à faible énergie correspond à une réaction rapide et une barrière à haute énergie correspond à une réaction lente. Une réaction est en équilibre lorsque la vitesse de réaction directe est égale à la vitesse de réaction inverse. Une telle réaction est dite réversible. Si la matière de départ et le (s) produit (s) sont en équilibre, leur abondance relative est déterminée par la différence d'énergie libre entre eux. En principe, toutes les étapes élémentaires sont réversibles, mais dans de nombreux cas l'équilibre se situe tellement vers le côté produit que la matière de départ n'est effectivement plus observable ou présente en concentration suffisante pour avoir un effet sur la réactivité. En pratique, la réaction est considérée comme irréversible.
Alors que la plupart des processus réversibles auront un K raisonnablement petit de 10 3 ou moins, ce n'est pas une règle absolue et un certain nombre de processus chimiques nécessitent la réversibilité de réactions même très favorables. Par exemple, la réaction d'un acide carboxylique avec des amines pour former un sel a lieu avec K de 10 5–6 , et à des températures ordinaires, ce processus est considéré comme irréversible. Pourtant, avec un chauffage suffisant, la réaction inverse a lieu pour permettre la formation de l'intermédiaire tétraédrique et, finalement, de l'amide et de l'eau. (Pour un exemple extrême nécessitant la réversibilité d'une étape avec K > 10 11 , voir déméthylation .) Une réaction peut également être rendue irréversible si une étape ultérieure plus rapide a lieu pour consommer le (s) produit (s) initial (s), ou si un gaz est dégagé dans un système ouvert. Ainsi, aucune valeur de K ne sert de «ligne de partage» entre les processus réversibles et irréversibles. Au lieu de cela, la réversibilité dépend de l'échelle de temps, de la température, des conditions de réaction et du paysage énergétique global.
Lorsqu'un réactif peut former deux produits différents en fonction des conditions de réaction, il devient important de choisir les bonnes conditions pour favoriser le produit souhaité. Si une réaction est effectuée à une température relativement plus basse, alors le produit formé est celui qui se trouve à travers la plus petite barrière d'énergie. C'est ce qu'on appelle le contrôle cinétique et le rapport des produits formés dépend des barrières énergétiques relatives conduisant aux produits. Les stabilités relatives des produits n'ont pas d'importance. Cependant, à des températures plus élevées, les molécules ont suffisamment d'énergie pour traverser les deux barrières énergétiques menant aux produits. Dans un tel cas, le rapport produit est déterminé uniquement par les énergies des produits et les énergies de la barrière n'ont pas d'importance. Ceci est connu sous le nom de contrôle thermodynamique et il ne peut être obtenu que lorsque les produits peuvent s'inter-convertir et s'équilibrer dans les conditions de réaction. Un diagramme de coordonnées de réaction peut également être utilisé pour illustrer qualitativement le contrôle cinétique et thermodynamique dans une réaction.
Applications
Voici quelques exemples sur la façon d'interpréter les diagrammes de coordonnées de réaction et de les utiliser pour analyser les réactions.
Effet solvant: En général, si l'état de transition pour l'étape de détermination de la vitesse correspond à une espèce plus chargée par rapport au matériau de départ, l'augmentation de la polarité du solvant augmentera la vitesse de la réaction car un solvant plus polaire sera plus efficace pour stabiliser l'état de transition (ΔG ‡ diminuerait). Si la structure de l'état de transition correspond à une espèce moins chargée, l'augmentation de la polarité des solvants diminuerait la vitesse de réaction car un solvant plus polaire serait plus efficace pour stabiliser le matériau de départ (ΔG o diminuerait ce qui à son tour augmenterait ΔG ‡ ).
S N 1 contre S N 2
Les mécanismes S N 1 et S N 2 sont utilisés à titre d'exemple pour démontrer comment les effets des solvants peuvent être indiqués dans les diagrammes de coordonnées de réaction.
- S N 1: La figure 10 montre l'étape de détermination de la vitesse pour un mécanisme S N 1, la formation de l' intermédiaire de carbocation et le diagramme de coordonnées de réaction correspondant. Pour un mécanisme S N 1, la structure d'état de transition montre une densité de charge partielle par rapport à la structure d'état fondamental neutre. Par conséquent, augmenter la polarité du solvant, par exemple des hexanes (représentés en bleu) à l'éther (représentés en rouge), diminuerait la vitesse de la réaction. Comme le montre la figure 9, le matériau de départ a approximativement la même stabilité dans les deux solvants (donc ΔΔG o = ΔG o polaire - ΔG o non polaire est petit) et l'état de transition est plus stabilisé en éther signifiant ΔΔG ≠ = ΔG ≠ polaire - ΔG ≠ non polaire est grand.
- S N 2: Pour un mécanisme S N 2, un nucléophile fortement basique (c'est-à-dire un nucléophile chargé) est favorable. Sur la figure 11 ci-dessous, l'étape de détermination de la vitesse pour la synthèse de l'éther Williamson est représentée. Le matériau de départ est le chlorure de méthyle et un ion éthoxyde qui a une charge négative localisée, ce qui signifie qu'il est plus stable dans les solvants polaires. La figure montre une structure d'état de transition lorsque le chlorure de méthyle subit une attaque nucléophile. Dans la structure à l'état de transition, la charge est répartie entre les atomes de Cl et O et le solvant plus polaire est moins efficace pour stabiliser la structure à l'état de transition par rapport aux matières de départ. En d'autres termes, la différence d'énergie entre le solvant polaire et non polaire est plus importante pour l'état fondamental (pour le matériau de départ) que pour l'état de transition.
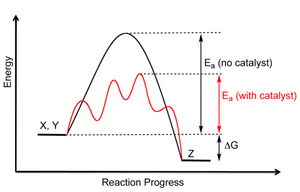
Catalyseurs: Il existe deux types de catalyseurs , positifs et négatifs. Les catalyseurs positifs augmentent la vitesse de réaction et les catalyseurs négatifs (ou inhibiteurs) ralentissent une réaction et peuvent empêcher la réaction du tout. Le but d'un catalyseur est de modifier l'énergie d'activation. La figure 12 illustre le but d'un catalyseur en ce que seule l' énergie d'activation est modifiée et non les stabilités thermodynamiques relatives, représentées sur la figure par AH, des produits et réactifs. Cela signifie qu'un catalyseur ne modifiera pas les concentrations à l'équilibre des produits et des réactifs mais permettra seulement à la réaction d'atteindre l'équilibre plus rapidement. La figure 13 montre la voie catalysée se produisant en plusieurs étapes, ce qui est une représentation plus réaliste d'un processus catalysé. La nouvelle voie catalysée peut se produire par le même mécanisme que la réaction non catalysée ou par un mécanisme alternatif. Une enzyme est un catalyseur biologique qui augmente la vitesse de nombreuses réactions biochimiques vitales. La figure 13 montre une manière courante d'illustrer l'effet d'une enzyme sur une réaction biochimique donnée.
Voir également
- Énergie gratuite Gibbs
- Enthalpie
- Entropie
- Chimie computationnelle
- Mécanique moléculaire
- Approximation Born-Oppenheimer

















