Epibatidine - Epibatidine
 | |
 | |
| Identifiants | |
|---|---|
| |
| Numero CAS | |
| CID PubChem | |
| Banque de médicaments | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Carte d'information de l'ECHA |
100.162.281 |
| Données chimiques et physiques | |
| Formule | C 11 H 13 Cl N 2 |
| Masse molaire | 208,69 g·mol -1 |
| Modèle 3D ( JSmol ) | |
| |
| |
|
| |
L'épibatidine est un alcaloïde chloré sécrété par la grenouille équatorienne Epipedobates anthonyi et les grenouilles venimeuses du genre Ameerega. Il a été découvert par John W. Daly en 1974, mais sa structure n'a été complètement élucidée qu'en 1992. Que l'épibatidine soit le premier exemple observé d'un alcaloïde chloré reste controversé, en raison des difficultés rencontrées pour identifier de manière concluante le composé à partir des échantillons limités collectés par Daly. . Au moment où la spectrométrie à haute résolution a été utilisée en 1991, il restait moins d'un milligramme d'extrait des échantillons de Daly, ce qui soulève des inquiétudes quant à une éventuelle contamination. Des échantillons provenant d'autres lots de la même espèce de grenouille n'ont pas produit d'épibatidine.
L'épibatidine est toxique. Sa toxicité provient de sa capacité à interagir avec les récepteurs nicotiniques et muscariniques de l'acétylcholine . Ces récepteurs sont impliqués dans la transmission des sensations douloureuses, et dans le mouvement, entre autres fonctions. L'épibatidine provoque alors un engourdissement et, éventuellement, une paralysie. Les doses sont mortelles lorsque la paralysie provoque un arrêt respiratoire. À l'origine, on pensait que l'épibatidine pouvait être utile en tant que médicament. Cependant, en raison de son index thérapeutique inacceptable , il ne fait plus l'objet de recherches pour des utilisations thérapeutiques potentielles.
Histoire
L'épibatidine a été découverte par John W. Daly en 1974. Elle a été isolée de la peau de grenouilles Epipedobates anthonyi recueillies par Daly et son collègue, Charles Myers. Entre 1974 et 1979, Daly et Myers ont collecté les peaux de près de 3000 grenouilles sur divers sites en Équateur, après avoir découvert qu'une petite injection d'une préparation à partir de leur peau provoquait des effets analgésiques (analgésiques) chez des souris qui ressemblaient à ceux d'un opioïde . Malgré son nom commun - Anthony's Poison Arrow Frog - suggérant qu'il était utilisé par les indigènes lors de la chasse, un article écrit par Daly en 2000 affirmait qu'il n'y avait pas de folklore local ou de médecine populaire entourant les grenouilles et qu'elles étaient considérées comme largement sans importance par les habitants. .
La structure de l'épibatidine a été élucidée en 1992, un effort entravé par l' obtention du statut de protection de l'UICN par E. anthonyi en 1984. De plus, ces grenouilles ne produisent pas la toxine lorsqu'elles sont reproduites et élevées en captivité, car elles ne synthétisent pas elles-mêmes l'épibatidine. Comme les autres grenouilles venimeuses, elles l'obtiennent plutôt par le biais de leur alimentation, puis la séquestrent sur leur peau. Les sources alimentaires probables sont les coléoptères, les fourmis, les acariens et les mouches. Surmontant les difficultés, la structure a finalement été déterminée et la première synthèse d'épibatidine a été achevée en 1993. De nombreuses autres méthodes de synthèse ont été développées depuis.
En raison de son effet analgésique, l'utilisation de l'épibatidine en tant que médicament a suscité un vif intérêt, car il s'est avéré qu'il ne s'agissait pas d'un opioïde. Cela signifiait qu'il pouvait potentiellement être utilisé sans crainte de dépendance. Cependant, il a été rapidement découvert qu'il ne peut pas être utilisé chez l'homme car la dose entraînant des symptômes toxiques est trop faible pour qu'il soit sans danger.
Synthèse
Plusieurs voies de synthèse totale ont été imaginées en raison de la rareté relative de l'épibatidine dans la nature.
Après la découverte de la structure de l'épibatidine, plus de cinquante façons de la synthétiser en laboratoire ont été imaginées. Dans le premier exemple rapporté, une procédure en neuf étapes produit la substance sous forme de racémate (en revanche, le composé naturel est l'énantiomère (+) ; l'énantiomère (-) n'apparaît pas naturellement). Il a été déterminé plus tard que les énantiomères (+) et (-) avaient des effets analgésiques et toxiques équivalents. Le procédé s'est avéré très productif, avec un rendement d'environ 40 %.
Une synthèse énantiosélective rapportée par EJ Corey à partir du chloronicotinaldéhyde est décrite ci-dessous :
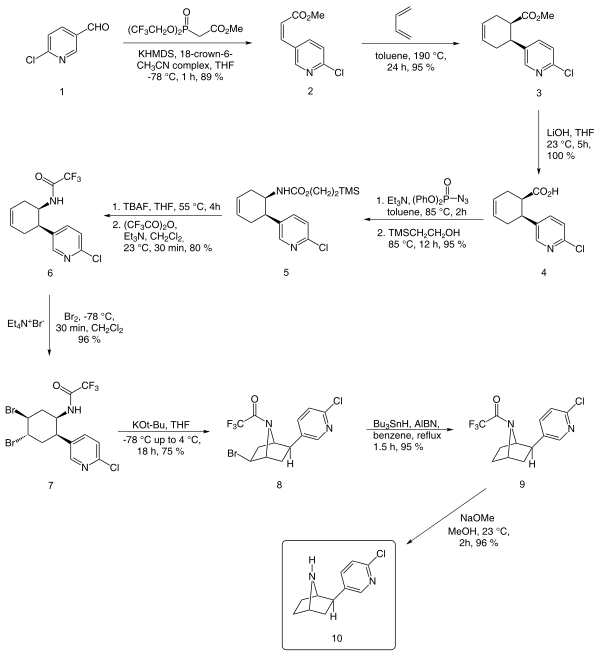
En plus de la méthode de Corey, d'autres méthodes notables incluent celles de Broka, Huang et Shen, et Clayton et Regan.
Analogues synthétiques
Un certain nombre d'approches pour découvrir des analogues structuraux de l'épibatine qui maintiennent les effets analgésiques, mais sans la toxicité, ont été tentées. Par exemple, Abbott Laboratories a produit des dérivés d'épibatidine dont l' ABT-594 . D'autres analogues de l'épibatidine comprennent l' ABT-418 , l' épiboxidine et leurs dérivés. Une synthèse d'épibatidine, utilisant une hydroxylation microbienne d'un charbon non activé dans un 7-azanorbornane a été publiée en 1999.
Structure chimique
L'épibatidine est une pyridine de structure similaire à celle de la nicotine . C'est une substance huileuse hygroscopique qui est une base .
Effets biologiques
Mécanisme d'action
L'épibatidine a deux mécanismes d'action : elle peut se lier aux récepteurs nicotiniques de l'acétylcholine (nAChR) ou aux récepteurs muscariniques de l'acétylcholine (mAChR). Plus précisément, on pense que la propriété analgésique de l'épibatidine se produit par sa liaison au sous-type α4/β2 des récepteurs nicotiniques. L'épibatidine se lie également au sous-type α3/β4 et dans une bien moindre mesure aux récepteurs α7 (affinité 300 fois moindre que pour α4/β2 ). L'ordre de classement des affinités est αε > αγ > αδ.
Les récepteurs nicotiniques de l'acétylcholine se trouvent dans les membranes post-synaptiques des cellules nerveuses. Ils propagent la neurotransmission dans le système nerveux central et périphérique . Lorsque les neurotransmetteurs se lient à ces récepteurs, les canaux ioniques s'ouvrent, permettant aux ions Na + et Ca 2+ de traverser la membrane. Cela dépolarise la membrane post-synaptique, induisant un potentiel d'action qui propage le signal. Ce signal induira finalement la libération de dopamine et de noradrénaline , entraînant un effet antinociceptif sur l'organisme. Le neurotransmetteur habituel du nAChR est l'acétylcholine. Cependant, d'autres substances (telles que l'épibatidine et la nicotine ) sont également capables de se lier au récepteur et d'induire une réponse similaire, voire identique. L'épibatidine a une affinité extrêmement élevée pour les nAChR, selon le sous-type de récepteur, de 0,05 nM au sous-type α4β2 à 22 nM au sous-type α7. L'affinité ainsi que l' efficacité (et donc aussi la puissance ) sont beaucoup plus élevées que pour la nicotine.
La propriété paralytique de l'épibatidine a lieu après sa liaison aux récepteurs nicotiniques de type musculaire .
De faibles doses d'épibatidine n'affecteront que les nAChR, en raison d'une affinité plus élevée pour les nAChR que pour les mAChR. Des doses plus élevées, cependant, entraîneront la liaison de l'épibatidine aux mAChR.
Les énantiomères (+) et (-) de l'épibatidine sont tous deux biologiquement actifs et ont tous deux des affinités de liaison similaires avec les nAChR. Seul l'énantiomère (+) n'induit pas de tolérance. Bien que cela puisse être un avantage thérapeutique potentiel par rapport à la morphine, l'épibatidine n'a pas fait l'objet d'essais cliniques car même de très petites doses sont mortelles pour les rongeurs.
Symptômes
L'épibatidine a plusieurs conséquences toxiques. Les effets empiriquement prouvés incluent une décharge du nerf sympathique splanchnique et une augmentation de la pression artérielle. Les effets de décharge nerveuse peuvent provoquer une antinociception partiellement médiée par l'agonisme des récepteurs nicotiniques centraux de l'acétylcholine à de faibles doses d'épibatidine; 5 µg/kg. À des doses plus élevées, cependant, l'épibatidine provoquera une paralysie et une perte de conscience, un coma et éventuellement la mort. La dose létale médiane (DL 50 ) d'épibatidine se situe entre 1,46 µg/kg et 13,98 µg/kg. Cela rend l'épibatidine un peu plus toxique que la dioxine (avec une DL 50 moyenne de 22,8 µg/kg). En raison de la faible différence entre sa concentration toxique et sa concentration antinociceptive, ses utilisations thérapeutiques sont très limitées.
Dans la recherche sur la souris, l'administration de doses supérieures à 5 µg/kg d'épibatidine a provoqué un effet paralysant dose-dépendant sur l'organisme. Avec des doses supérieures à 5 g/kg, les symptômes comprenaient une hypertension (augmentation de la pression artérielle), une paralysie du système respiratoire , des convulsions et, finalement, la mort. Cependant, les symptômes changent radicalement lorsque des doses plus faibles sont administrées. Les souris sont devenues résistantes à la douleur et à la chaleur sans aucun des effets négatifs de doses plus élevées.
Pharmacologie
L'épibatidine pénètre le plus efficacement dans le corps par injection. Des études in vitro semblent suggérer que l'épibatidine est à peine, voire pas du tout, métabolisée dans le corps humain.
De plus, il existe actuellement peu d'informations sur le chemin d'élimination du corps. La concentration maximale dans le cerveau est atteinte environ 30 minutes après l'entrée dans le corps.
Utilisations médicales potentielles
L'épibatidine a une puissance analgésique élevée, comme indiqué ci-dessus. Des études montrent qu'il a une puissance au moins 200 fois supérieure à celle de la morphine . Comme le composé ne crée pas de dépendance et ne provoque pas d' accoutumance , on a d'abord pensé qu'il était très prometteur de remplacer la morphine comme analgésique. Cependant, la concentration thérapeutique est très proche de la concentration toxique. Cela signifie que même à une dose thérapeutique (5 µg/kg), une partie de l'épibatidine peut se lier aux récepteurs muscariniques de l'acétylcholine et provoquer des effets indésirables, tels que l' hypertension , la bradycardie et la parésie musculaire .
Par rapport à l'étalon-or dans la gestion de la douleur, la morphine , l'épibatidine n'avait besoin que de 2,5 g/kg pour initier un effet analgésique tandis que le même effet nécessitait environ 10 mg/kg de morphine (4 000 fois l'efficacité.) Actuellement, seules des recherches rudimentaires sur les effets de l'épibatidine n'ont pas encore été réalisés ; le médicament n'a été administré qu'à des rongeurs pour analyse pour le moment.
Antidote
L'antidote à l'épibatidine est la mécamylamine , un antagoniste des récepteurs nicotiniques de l'acétylcholine non sélectif et non compétitif.
Voir également
- 6-chloronicotine
- Poison de flèche
- Batrachotoxine (et homobatrachotoxine étroitement apparentée )
- Nemertelline , neurotoxine étroitement liée à la nicotelline
- Phantasmidine
- Tétrodotoxine

