Nitrate de plomb (II) - Lead(II) nitrate
|
|
|||
| Propriétés | |||
|---|---|---|---|
| Pb (NO 3 ) 2 | |||
| Masse molaire | 331,2 g / mol | ||
| Apparence | incolore ou blanc | ||
| Densité | 4,53 g / cm 3 | ||
| Point de fusion | se décompose | ||
| 376,5 g / L (0 ° C) 597 g / L (25 ° C) 1270 g / L (100 ° C) |
|||
| Dangers | |||
| Fiche de données de sécurité | ICSC 1000 | ||
|
Classification UE (DSD) (obsolète)
|
Repr. Chat. 1/3 Toxique ( T ) Nocif ( Xn ) Dangereux pour l'environnement ( N ) |
||
| NFPA 704 (diamant de feu) | |||
| Dose ou concentration létale (DL, LC): | |||
|
LD Lo (le plus bas publié )
|
500 mg / kg (cobaye, voie orale) | ||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|||
| Références Infobox | |||
Le nitrate de plomb (II) est un composé inorganique de formule chimique Pb ( NO 3 ) 2 . Il se présente généralement sous forme de cristal incolore ou de poudre blanche et, contrairement à la plupart des autres sels de plomb (II) , il est soluble dans l' eau .
Connue depuis le Moyen Âge sous le nom de plumbum dulce , la production de nitrate de plomb (II) à partir de plomb métallique ou d' oxyde de plomb dans l'acide nitrique était à petite échelle, pour une utilisation directe dans la fabrication d'autres composés de plomb . Au XIXe siècle, le nitrate de plomb (II) a commencé à être produit commercialement en Europe et aux États-Unis. Historiquement, l'utilisation principale était comme matière première dans la production de pigments pour peintures au plomb , mais ces peintures ont été remplacées par des peintures moins toxiques à base de dioxyde de titane . D'autres utilisations industrielles comprenaient la stabilisation thermique dans le nylon et les polyesters , et dans les revêtements de papier photothermographique . Depuis environ l'an 2000, le nitrate de plomb (II) a commencé à être utilisé dans la cyanuration de l'or .
Le nitrate de plomb (II) est toxique et doit être manipulé avec précaution pour éviter l'inhalation, l'ingestion et le contact avec la peau. En raison de sa nature dangereuse , les applications limitées du nitrate de plomb (II) sont constamment surveillées.
L'histoire
Le nitrate de plomb a été identifié pour la première fois en 1597 par l' alchimiste Andreas Libavius , qui a appelé la substance plumbum dulce , ce qui signifie «plomb doux», en raison de son goût. Il est produit commercialement par réaction du plomb métallique avec de l'acide nitrique concentré dans lequel il est peu soluble. Il a été produit comme matière première pour la fabrication de pigments tels que le jaune de chrome (chromate de plomb (II), PbCrO 4 ) et orange de chrome (chromate de plomb basique (II), Pb 2 CrO 5 ) et le jaune de Naples . Ces pigments étaient utilisés pour la teinture et l'impression du calicot et d'autres textiles. Il a été utilisé comme oxydant dans la poudre noire et avec l'azide de plomb dans des explosifs spéciaux .
Production
Le nitrate de plomb est produit par réaction de l' oxyde de plomb (II) avec de l'acide nitrique concentré:
- PbO + 2 HNO 3 (concentré) → Pb (NO 3 ) 2 ↓ + H 2 O
On peut également obtenir l'évaporation de la solution obtenue par réaction du plomb métallique avec de l'acide nitrique dilué .
- Pb + 4 HNO 3 → Pb (NO 3 ) 2 + 2 NO 2 + 2 H 2 O
Des solutions et des cristaux de nitrate de plomb (II) se forment lors du traitement des déchets de plomb- bismuth des raffineries de plomb.
Structure
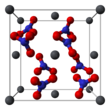
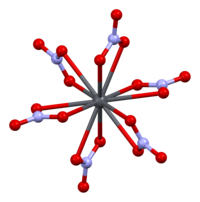
La structure cristalline du nitrate de plomb solide (II) a été déterminée par diffraction neutronique . Le composé cristallise dans le système cubique avec les atomes de plomb dans un système cubique à faces centrées . Son groupe d'espace est Pa3 Z = 4 ( notation de réseau de Bravais ), avec chaque côté du cube d'une longueur de 784 picomètres .
Les points noirs représentent les atomes de plomb, les points blancs les groupes nitrate 27 picomètres au-dessus du plan des atomes de plomb et les points bleus les groupes nitrate à la même distance en dessous de ce plan. Dans cette configuration, chaque atome de plomb est lié à douze atomes d'oxygène ( longueur de liaison : 281 pm). Toutes les longueurs de liaison N – O sont identiques, à 127 picomètres.
L'intérêt de la recherche dans la structure cristalline du nitrate de plomb (II) était en partie basé sur la possibilité d'une rotation interne libre des groupes nitrate dans le réseau cristallin à des températures élevées, mais cela ne s'est pas concrétisé.
Propriétés chimiques et réactions
Le nitrate de plomb se décompose en chauffant, une propriété qui a été utilisée en pyrotechnie . Il est soluble dans l'eau et dilue l'acide nitrique.
Des nitrates basiques se forment lorsque l'alcali est ajouté à une solution. Pb 2 (OH) 2 (NO 3 ) 2 est l'espèce prédominante formée à faible pH. A un pH plus élevé, du Pb 6 (OH) 5 (NO 3 ) se forme. Le cation [Pb 6 O (OH) 6 ] 4+ est inhabituel en ce qu'il a un ion oxyde à l'intérieur d'un amas de 3 tétraèdres PbO 4 à faces partagées . Il n'y a aucune preuve de la formation de l'hydroxyde, Pb (OH) 2 , en solution aqueuse à un pH inférieur à 12.
Des solutions de nitrate de plomb peuvent être utilisées pour former des complexes de coordination. Le plomb (II) est un accepteur dur ; il forme des complexes plus forts avec les ligands donneurs d'électrons d' azote et d' oxygène . Par exemple, la combinaison de nitrate de plomb et de pentaéthylène glycol (OE 5 ) dans une solution d' acétonitrile et de méthanol suivie d'une lente évaporation a produit le composé [Pb (NO 3 ) 2 (EO 5 )]. Dans la structure cristalline de ce composé, la chaîne EO 5 est enroulée autour de l'ion plomb dans un plan équatorial similaire à celui d'un éther couronne . Les deux nitrates bidentates ligands sont en configuration trans . Le nombre total de coordination est de 10, avec l'ion plomb dans une géométrie moléculaire antiprisme carrée à deux capuchons .
Le complexe formé par le nitrate de plomb avec un ligand N-donneur bidentate de bithiazole est binucléaire. La structure cristalline montre que le groupe nitrate forme un pont entre deux atomes de plomb. Un aspect intéressant de ce type de complexes est la présence d'un espace physique dans la sphère de coordination ; c'est-à-dire que les ligands ne sont pas placés symétriquement autour de l'ion métallique. Ceci est potentiellement dû à une paire d'électrons solitaires en plomb , également trouvée dans des complexes de plomb avec un ligand imidazole .
Applications
Le nitrate de plomb a été utilisé comme stabilisant thermique dans le nylon et les polyesters, comme revêtement pour papier photothermographique et dans les rodenticides .
Le chauffage du nitrate de plomb est un moyen pratique de fabriquer du dioxyde d'azote
- 2 Pb (NO 3 ) 2 → 2 PbO + 4 NO 2 + O 2
Dans le processus de cyanuration de l' or , l'ajout d'une solution de nitrate de plomb (II) améliore le processus de lixiviation . Seules des quantités limitées (10 à 100 milligrammes de nitrate de plomb par kilogramme d'or) sont nécessaires.
En chimie organique, il peut être utilisé dans la préparation d' isothiocyanates à partir de dithiocarbamates . Son utilisation comme piégeur de bromure lors de la substitution S N 1 a été rapportée.
Sécurité
Le nitrate de plomb (II) est toxique et son ingestion peut entraîner une intoxication aiguë par le plomb, comme cela s'applique à tous les composés solubles du plomb. Tous les composés inorganiques principaux sont classés par le Centre international de recherche sur le cancer (CIRC) comme probablement cancérogènes pour l'homme (catégorie 2A). Ils ont été liés au cancer du rein et au gliome chez les animaux de laboratoire et au cancer du rein, au cancer du cerveau et au cancer du poumon chez l'homme, bien que les études sur des travailleurs exposés au plomb soient souvent compliquées par une exposition concomitante à l' arsenic . Le plomb est connu de substituer à zinc dans un certain nombre d' enzymes , y compris la déshydratase de l' acide δ-aminolévulinique (porphobilinogène synthase) dans l' hème voie de biosynthèse et de pyrimidine-5'-nucléotidase , important pour le métabolisme correcte de l' ADN et peuvent donc causer des dommages du fœtus.
Références
Liens externes
- Woodbury, William D. (1982). "Lead" . Annuaire des minéraux des métaux et minéraux . Bureau des mines : 515–42 . Récupéré le 18 janvier 2008 .
- "Lead" . NIOSH Pocket Guide to Chemical Hazards . Institut national pour la sécurité et la santé au travail. Septembre 2005. NIOSH 2005-149 . Récupéré le 19 janvier 2008 .
- "Fiche d'information sur les composés de plomb et de plomb" . Inventaire national des polluants . Gouvernement australien, Département de l'environnement et des ressources en eau. Juillet 2007. Archivé de l'original le 11 janvier 2008 . Récupéré le 19 janvier 2008 .
- "Lead" . Un environnement domestique sain, risques pour la santé . Alliance américaine pour des maisons saines. Archivé de l'original le 20/02/2008 . Récupéré le 19 janvier 2008 .
- Fiches de données de sécurité
- MSDS pour le nitrate de plomb, PTCL, Université d'Oxford
- Fiche signalétique pour le nitrate de plomb, Science Stuff Inc
- MSDS pour le nitrate de plomb, Iowa State University