Mélanopsine - Melanopsin
La mélanopsine est un type de photopigment appartenant à une plus grande famille de protéines rétiniennes sensibles à la lumière appelées opsines et codées par le gène Opn4 . Dans la rétine des mammifères, il existe deux catégories supplémentaires d'opsines, toutes deux impliquées dans la formation d'images visuelles : la rhodopsine et la photopsine (types I, II et III) dans les cellules photoréceptrices en bâtonnet et en cône , respectivement.
Chez l'homme, la mélanopsine se trouve dans les cellules ganglionnaires rétiniennes intrinsèquement photosensibles (ipRGC). On le trouve également dans l'iris des souris et des primates. La mélanopsine est également présente chez le rat, l' amphioxus et d'autres cordés. Les ipRGC sont des cellules photoréceptrices particulièrement sensibles à l'absorption de la lumière visible à courte longueur d'onde (bleue) et communiquent des informations directement à la zone du cerveau appelée noyau suprachiasmatique (SCN), également appelée « horloge biologique » centrale chez les mammifères. . La mélanopsine joue un rôle important non formateur d'image dans le réglage des rythmes circadiens ainsi que d'autres fonctions. Des mutations du gène Opn4 peuvent entraîner des troubles cliniques, tels que le trouble affectif saisonnier (TAS). Selon une étude, la mélanopsine a été trouvée dans dix-huit sites du cerveau humain (en dehors du tractus rétinohypothalamique), de manière intracellulaire, sous forme granuleuse, dans le cortex cérébral, le cortex cérébelleux et plusieurs régions phylogénétiquement anciennes, principalement dans le soma neuronal, non dans les noyaux. La mélanopsine est également exprimée dans les cônes humains. Cependant, seulement 0,11 % à 0,55 % des cônes humains expriment la mélanopsine et se trouvent exclusivement dans les régions périphériques de la rétine. La rétine périphérique humaine détecte la lumière à des intensités élevées qui s'expliquent le mieux par quatre classes différentes de photopigments.
Découverte
La mélanopsine a été découverte pour la première fois par Ignacio Provencio en tant que nouvelle opsine dans les mélanophores , ou cellules cutanées sensibles à la lumière, de la grenouille africaine à griffes en 1998. Un an plus tard, les chercheurs ont découvert que des souris sans bâtonnets ni cônes , les cellules impliquées dans l'image- formant une vision, toujours entraînée dans un cycle lumière-obscurité. Cette observation a conduit à la conclusion que ni les bâtonnets ni les cônes, situés dans la rétine externe , ne sont nécessaires à l'entraînement circadien et qu'une troisième classe de photorécepteurs existe dans l'œil des mammifères. Provencio et ses collègues ont ensuite découvert en 2000 que la mélanopsine est également présente dans la rétine de souris, en particulier dans les cellules ganglionnaires , et qu'elle médie les tâches photoréceptives non visuelles. La mélanopsine s'est avérée être codée par Opn4 avec des orthologues dans une variété d'organismes.
Ces cellules ganglionnaires rétiniennes se sont révélées être naturellement photosensibles, car elles répondaient à la lumière même lorsqu'elles étaient isolées, et ont donc été appelées cellules ganglionnaires rétiniennes intrinsèquement photosensibles (ipRGC) . Ils constituent une troisième classe de cellules photoréceptrices dans la rétine des mammifères, en plus des bâtonnets et des cônes déjà connus, et se sont avérés être le principal conduit d'apport de lumière au photoentraînement circadien . En fait, il a été démontré plus tard par Satchidananda Panda et ses collègues que le pigment mélanopsine peut être impliqué dans l'entraînement d'un oscillateur circadien aux cycles lumineux chez les mammifères, car la mélanopsine était nécessaire pour que les souris aveugles répondent à la lumière.
Répartition des espèces
Les mammifères ont des gènes de mélanopsine orthologues nommés Opn4m , qui sont dérivés d'une branche de la famille Opn4 , et sont conservés à environ 50 à 55 %. Cependant, les vertébrés non mammifères, y compris les poulets et les poissons zèbres, ont une autre version du gène de la mélanopsine, Opn4x , qui semble avoir une lignée distincte qui a divergé d' Opn4m il y a environ 360 millions d'années. Les mammifères ont perdu le gène Opn4x relativement tôt dans leur évolution, entraînant une réduction générale de la capacité photosensorielle. On pense que cet événement peut s'expliquer par le fait qu'il s'est produit à l'époque où les mammifères nocturnes évoluaient.
Structure
Le gène de la mélanopsine humaine, opn4 , est exprimé dans les ipRGC , qui ne comprennent que 1 à 2 % des RGC dans la rétine interne des mammifères, comme l'ont étudié Samer Hattar et ses collègues. Le gène s'étend sur environ 11,8 kb et est mappé sur le bras long du chromosome 10 . Le gène comprend neuf introns et dix exons par rapport aux quatre à sept exons généralement trouvés dans les autres opsines humaines. Chez les vertébrés non mammifères, la mélanopsine se trouve dans un sous-ensemble plus large de cellules rétiniennes, ainsi que dans des structures photosensibles à l'extérieur de la rétine, telles que le muscle de l' iris de l'œil, les régions cérébrales profondes, la glande pinéale et la peau. Les paralogues d' Opn4 incluent OPN1LW, OPN1MW, RHO et OPN3 et ont été découverts par le projet Genome.
La mélanopsine, comme toutes les autres opsines animales (par exemple la rhodopsine ), est un membre de la famille des récepteurs couplés aux protéines G (RCPG) . La protéine mélanopsine possède sept hélices alpha intégrées dans la membrane plasmique, un domaine N-terminal et un domaine C-terminal . Il ressemble beaucoup plus aux opsines d' invertébrés qu'aux photopigments de vertébrés , en particulier dans sa séquence d'acides aminés et sa cascade de signalisation en aval . Comme les opsines d'invertébrés, il semble être un photopigment avec une activité intrinsèque de photoisomérase et des signaux via une protéine G de la famille Gq.
Fonction
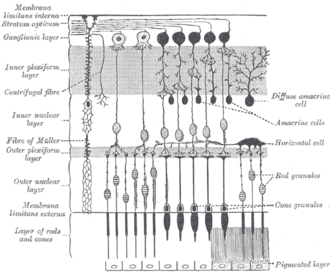
Les cellules ganglionnaires contenant de la mélanopsine, comme les bâtonnets et les cônes, présentent à la fois une adaptation à la lumière et à l'obscurité ; ils ajustent leur sensibilité en fonction de l'histoire récente de l'exposition à la lumière. Cependant, alors que bâtonnets et les cônes sont responsables de la réception des images, des motifs, le mouvement et la couleur, contenant mélanopsine ipRGCs contribuent à diverses réponses réflexes du cerveau et du corps à la présence de la lumière.
Les preuves de la détection de la lumière physiologique de la mélanopsine ont été testées chez la souris. Une lignée cellulaire de souris qui n'est normalement pas photosensible, Neuro-2a , est rendue sensible à la lumière par l'ajout de mélanopsine humaine. La photoréponse est sélectivement sensible à la lumière de courte longueur d'onde (absorption maximale ~ 479 nm) et possède une fonction intrinsèque de régénération de la photoisomérase qui est chromatiquement décalée vers des longueurs d'onde plus longues.
Les photorécepteurs à mélanopsine sont sensibles à une gamme de longueurs d'onde et atteignent un pic d'absorption lumineuse à des longueurs d'onde de lumière bleue d'environ 480 nanomètres. D'autres longueurs d'onde de la lumière activent le système de signalisation de la mélanopsine avec une efficacité décroissante à mesure qu'elles s'éloignent de l'optimum de 480 nm. Par exemple, des longueurs d'onde plus courtes autour de 445 nm (plus proches du violet dans le spectre visible ) sont deux fois moins efficaces pour la stimulation des photorécepteurs à la mélanopsine que la lumière à 480 nm.
La mélanopsine dans l'iris de certains mammifères, principalement nocturnes, ferme l'iris lorsqu'il est exposé à la lumière. Ce réflexe pupillaire local (PLR) est absent chez les primates, même si leurs iris expriment la mélanopsine.
Mécanisme
Lorsque la lumière avec une fréquence appropriée pénètre dans l'œil, elle active la mélanopsine contenue dans les cellules ganglionnaires rétiniennes intrinsèquement photosensibles (ipRGC), déclenchant un potentiel d'action . Ces signaux électriques neuronaux voyagent à travers les axones neuronaux vers des cibles cérébrales spécifiques, telles que le centre de contrôle pupillaire appelé noyau prétectal olivaire (OPN) du mésencéphale. Par conséquent, la stimulation de la mélanopsine dans les ipRGC médie les réponses comportementales et physiologiques à la lumière, telles que la constriction pupillaire et l'inhibition de la libération de mélatonine par la glande pinéale . Les ipRGCs dans la rétine des mammifères sont une extrémité du tractus rétinohypothalamique qui se projette vers le noyau suprachiasmatique (SCN) de l' hypothalamus . Le noyau suprachiasmatique est parfois décrit comme "l'horloge maîtresse" du cerveau, car il maintient le rythme circadien et les signaux nerveux des ipRGC au SCN entraînent le rythme circadien interne au lever et au coucher du soleil. Le SCN reçoit également des informations des bâtonnets et des cônes via le tractus rétinohypothalamique, de sorte que les informations des trois types de cellules photosensibles (bâtonnets, cônes et ipRGCs) dans la rétine des mammifères sont transmises au SCN (SCN).
On pense que les cellules ganglionnaires contenant de la mélanopsine influencent ces cibles en libérant les neurotransmetteurs glutamate et le polypeptide d'activation de l'adénylate cyclase hypophysaire (PACAP) à partir de leurs terminaisons axonales. Les cellules ganglionnaires contenant de la mélanopsine reçoivent également des apports de bâtonnets et de cônes qui peuvent s'ajouter à l'apport de ces voies.
Effets sur le rythme circadien
La mélanopsine joue un rôle important dans le photoentraînement des rythmes circadiens chez les mammifères. Un organisme photo - entraîné a aligné son activité sur un cycle d'environ 24 heures, le cycle solaire sur Terre. Chez les mammifères, les axones exprimant la mélanopsine ciblent le noyau suprachiasmatique (SCN) à travers le tractus rétinohypothalamique (RHT).
Chez les mammifères, l'œil est le principal organe photosensible pour la transmission des signaux lumineux au cerveau. Cependant, les humains aveugles sont toujours capables de s'entraîner dans le cycle lumière-obscurité de l'environnement, bien qu'ils n'aient aucune perception consciente de la lumière. Une étude a exposé des sujets à une lumière vive pendant une durée prolongée et mesuré leurs concentrations de mélatonine . La mélatonine n'a pas seulement été supprimée chez les humains non déficients visuels, mais aussi chez les participants aveugles, ce qui suggère que la voie photique utilisée par le système circadien est fonctionnellement intacte malgré la cécité. Par conséquent, les médecins ne pratiquent plus l' énucléation des patients aveugles, ou l'ablation des yeux à la naissance, puisque les yeux jouent un rôle essentiel dans le photoentraînement du stimulateur circadien.
Dans les races de souris mutantes qui ne manquaient que de bâtonnets, uniquement de cônes ou à la fois de bâtonnets et de cônes, toutes les races de souris étaient toujours entraînées à des stimuli lumineux changeants dans l'environnement, mais avec une réponse limitée, ce qui suggère que les bâtonnets et les cônes ne sont pas nécessaires pour le photoentraînement circadien et que l'œil des mammifères doit avoir un autre photopigment nécessaire à la régulation de l' horloge circadienne .
Les souris knock-out pour la mélanopsine présentent un photoentraînement réduit. Par rapport aux souris de type sauvage qui exprimaient normalement la mélanopsine, des déficits dans les déphasages induits par la lumière dans l'activité de locomotion ont été notés chez les souris sans mélanopsine ( Opn4 -/- ). Ces souris déficientes en mélanopsine n'ont pas complètement perdu leurs rythmes circadiens, car elles étaient toujours capables de s'entraîner à des stimuli environnementaux changeants, bien que plus lentement que la normale. Cela indiquait que, bien que la mélanopsine soit suffisante pour l'entraînement, elle doit fonctionner en conjonction avec d'autres photopigments pour une activité de photoentraînement normale. Les souris triples mutantes sans bâtonnet, sans cône et sans mélanopsine affichent une perte complète des rythmes circadiens, de sorte que les trois photopigments de ces photorécepteurs, la rhodopsine , la photopsine et la mélanopsine, sont nécessaires pour le photoentraînement. Par conséquent, il existe une redondance fonctionnelle entre les trois photopigments dans la voie de photoentraînement des mammifères. La suppression d'un seul photopigment n'élimine pas la capacité de l'organisme à s'entraîner dans les cycles lumière-obscurité de l'environnement, mais elle réduit l'intensité de la réponse.
Régulation
La mélanopsine subit une phosphorylation sur sa queue carboxy intracellulaire afin de désactiver sa fonction. Par rapport aux autres opsines, la mélanopsine a une queue carboxy inhabituellement longue qui contient 37 sites d'acides aminés de sérine et de thréonine qui pourraient subir une phosphorylation. Cependant, un groupe de sept acides aminés est suffisant pour désactiver la mélanopsine du poisson zèbre. Ces sites sont déphosphorylés lorsque la mélanopsine est exposée à la lumière et sont uniques de ceux qui régulent la rhodopsine. Ils sont importants pour une réponse appropriée aux ions calcium dans les ipRGC ; l'absence de sites de phosphorylation fonctionnels, en particulier au niveau de la sérine-381 et de la sérine-398, réduit la réponse de la cellule à l'influx d'ions calcium induit par la lumière lorsque les canaux ioniques calciques voltage-dépendants s'ouvrent.
En ce qui concerne le gène Opn4, la dopamine (DA) est un facteur de régulation de l' ARNm de la mélanopsine dans les ipRGC.
Signification clinique
La découverte du rôle de la mélanopsine dans la vision non formatrice d'images a conduit à une croissance de l' optogénétique . Ce domaine s'est révélé prometteur dans les applications cliniques, y compris le traitement des maladies oculaires humaines telles que la rétinite pigmentaire et le diabète . Une mutation faux-sens dans Opn4, P10L, a été impliquée chez 5% des patients atteints de trouble affectif saisonnier (TAS). Il s'agit d'une condition dans laquelle les gens éprouvent des pensées dépressives en hiver en raison d'une diminution de la lumière disponible. De plus, un récepteur à base de mélanopsine a été lié à la douleur migraineuse .
Restauration de la vue
Il y a eu des recherches récentes sur le rôle de la mélanopsine dans la thérapie optogénétique pour les patients atteints de la rétinite pigmentaire (RP) maladie oculaire dégénérative . La réintroduction de la mélanopsine fonctionnelle dans les yeux de souris atteintes de dégénérescence rétinienne restaure le réflexe pupillaire lumineux (PLR) . Ces mêmes souris pouvaient également distinguer les stimuli lumineux des stimuli sombres et ont montré une sensibilité accrue à la lumière ambiante. La sensibilité plus élevée démontrée par ces souris est prometteuse pour la restauration de la vision qui peut être applicable aux humains et aux maladies oculaires humaines.
Contrôle des rythmes veille/sommeil
La mélanopsine peut aider à contrôler les cycles de sommeil et l'éveil. Tsunematsu et ses collègues ont créé des souris transgéniques qui exprimaient la mélanopsine dans les neurones hypothalamiques à orexine . Avec une courte impulsion de lumière bleue de 4 secondes (guidée par des fibres optiques ), les souris transgéniques ont pu passer avec succès du sommeil à ondes lentes (SWS), communément appelé «sommeil profond», à un éveil de longue durée. Après avoir éteint la lumière bleue, les neurones hypothalamiques à orexine ont montré une activité pendant plusieurs dizaines de secondes. Il a été montré que les bâtonnets et les cônes ne jouent aucun rôle dans l'endormissement par la lumière, ce qui les distingue des ipRGCs et de la mélanopsine. Cela fournit des preuves solides qu'il existe un lien entre les ipRGC chez l'homme et la vigilance, en particulier avec la lumière à haute fréquence (par exemple la lumière bleue). Par conséquent, la mélanopsine peut être utilisée comme cible thérapeutique pour contrôler le cycle veille-sommeil.
Régulation de la glycémie
Dans un article publié par Ye et ses collègues en 2011, la mélanopsine a été utilisée pour créer un dispositif de transcription synthétique optogénétique qui a été testé dans un cadre thérapeutique pour produire le peptide 1 de type Fc-glucagon (Fc-GLP-1), une protéine de fusion qui aide contrôler la glycémie chez les mammifères atteints de diabète de type II . Les chercheurs ont implanté des souris par voie sous-cutanée avec des cellules HEK 293 transgéniques microencapsulées qui ont été cotransfectées avec deux vecteurs, dont le gène de la mélanopsine et le gène d'intérêt sous un promoteur NFAT ( facteur nucléaire des cellules T activées ), respectivement. C'est grâce à cette voie modifiée qu'ils ont réussi à contrôler l'expression du Fc-GLP-1 chez des souris diabétiques doublement récessives et à réduire l' hyperglycémie , ou taux de glycémie élevés, chez ces souris. Cela est prometteur pour l'utilisation de la mélanopsine comme outil optogénétique pour le traitement du diabète de type II.
Voir également
- Effets lumineux sur le rythme circadien
- Opsins
- Cellules ganglionnaires rétiniennes intrinsèquement photosensibles (ipRGC)
- Noyau suprachiasmatique (SCN)
- Voie rétinohypothalamique
Les références
Lectures complémentaires
- Rovere G, Nadal-Nicolás FM, Wang J, Bernal-Garro JM, García-Carrillo N, Villegas-Pérez MP, et al. (décembre 2016). "Réponse des cellules ganglionnaires rétiniennes contenant ou non de la mélanopsine à l'hypertension oculaire aiguë avec ou sans neuroprotection du facteur neurotrophique dérivé du cerveau" . Ophtalmologie d'investigation et sciences visuelles . 57 (15) : 6652-6661. doi : 10.1167/iovs.16-20146 . PMID 27930778 .





