Méthanethiol - Methanethiol
|
|||
|
|
|||
| Noms | |||
|---|---|---|---|
|
Nom IUPAC préféré
Méthanethiol |
|||
| Autres noms
Méthylmercaptan
Mercaptomethane Methiol thiométhyl alcool / Thiomethanol méthylthiol |
|||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| 3DMet | |||
| ChEBI | |||
| ChemSpider | |||
| Carte Info ECHA |
100 000 748 |
||
| Numéro CE | |||
| KEGG | |||
|
PubChem CID
|
|||
| Numéro RTECS | |||
| UNII | |||
| Numéro UN | 1064 | ||
|
Tableau de bord CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriétés | |||
| CH 3 SH | |||
| Masse molaire | 48,11 g · mol −1 | ||
| Apparence | gaz incolore | ||
| Odeur | Distinctif, comme celui du chou pourri ou des œufs | ||
| Densité | 0,9 g / mL (liquide à 0 ° C) | ||
| Point de fusion | −123 ° C (−189 ° F; 150 K) | ||
| Point d'ébullition | 5,95 ° C (42,71 ° F; 279,10 K) | ||
| 2% | |||
| Solubilité | alcool, éther | ||
| La pression de vapeur | 1,7 atm (20 ° C) | ||
| Acidité (p K a ) | ~ 10,4 | ||
| Dangers | |||
| Pictogrammes SGH |
  
|
||
| Mot de signalisation SGH | Danger | ||
| H220 , H331 , H400 , H410 | |||
| P210 , P261 , P271 , P273 , P304 + 340 , P311 , P321 , P377 , P381 , P391 , P403 , P403 + 233 , P405 , P501 | |||
| NFPA 704 (diamant de feu) | |||
| point de rupture | −18 ° C; 0 ° F; 255 K | ||
| Limites d'explosivité | 3,9% -21,8% | ||
| Dose ou concentration létale (DL, LC): | |||
|
DL 50 ( dose médiane )
|
60,67 mg / kg (mammifère) | ||
|
CL 50 ( concentration médiane )
|
3,3 ppm (souris, 2 h) 675 ppm (rat, 4 h) |
||
| NIOSH (limites d'exposition pour la santé aux États-Unis): | |||
|
PEL (autorisé)
|
C 10 ppm (20 mg / m 3 ) | ||
|
REL (recommandé)
|
C 0,5 ppm (1 mg / m 3 ) [15 minutes] | ||
|
IDLH (danger immédiat)
|
150 ppm | ||
| Composés apparentés | |||
|
Composés apparentés
|
Éthanethiol | ||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Références Infobox | |||
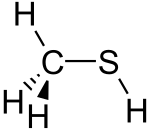
Méthanethiol / m ɛ θ eɪ n θ aɪ ɒ l / (également connu sous le méthyle mercaptan ) est un composé organique soufré avec la formule chimique CH
3 SH . C'est un gaz incolore avec une odeur putride distinctive. C'est une substance naturelle présente dans le sang , le cerveau et les excréments des animaux (y compris les humains), ainsi que dans les tissus végétaux . Il se produit également naturellement dans certains aliments, tels que certaines noix et le fromage . C'est l'un des composés chimiques responsables de la mauvaise haleine et de l'odeur de flatulence . Le méthanethiol est le thiol le plus simple et est parfois abrégé MeSH . C'est très inflammable.
Structure et réactions
La molécule est tétraédrique en carbone, comme le méthanol. C'est un acide faible , avec un p K a d'environ 10,4, mais il est environ un million de fois plus acide que le méthanol. Le sel incolore peut être obtenu de cette manière:
- CH 3 SH + CH 3 ONa → CH 3 SNa + CH 3 OH
L'anion thiolate résultant est un nucléophile puissant .
Il peut être oxydé en disulfure de diméthyle :
- 2CH 3 SH + [O] → CH 3 SSCH 3 + H 2 O
Une oxydation supplémentaire amène le disulfure en deux molécules d' acide méthanesulfonique , qui est inodore. L'eau de Javel désodorise le méthanethiol de cette manière.
Occurrence
Le méthanethiol (MeSH) est libéré en tant que sous-produit de la pâte kraft dans les usines de pâte à papier . Dans la pâte kraft, la lignine est dépolymérisée par attaque nucléophile avec l'ion hydrosulfure fortement nucléophile (HS - ) dans un milieu hautement alcalin. Cependant, dans une réaction secondaire, HS - attaque les groupes méthoxyle (OMe) dans la lignine , les déméthylant pour donner des groupes phénolates libres (PhO - ) et libérant MeSH. En raison de l'alcalinité, le MeSH est facilement déprotoné ( MeSNa ), et l' ion MeS - formé est également un nucléophile puissant, réagissant davantage au sulfure de diméthyle . Les composés restent dans la liqueur et sont brûlés dans la chaudière de récupération , où le soufre est récupéré sous forme de sulfure de sodium .
Le méthanethiol est libéré de la matière organique en décomposition dans les marais et est présent dans le gaz naturel de certaines régions, dans le goudron de houille et dans certains pétroles bruts . Il se produit dans diverses plantes et légumes, tels que les radis.
Dans l'eau de mer de surface, le méthanethiol est le principal produit de dégradation du métabolite algal diméthylsulfoniopropionate (DMSP). Les bactéries marines semblent obtenir la majeure partie du soufre contenu dans leurs protéines par la décomposition du DMSP et l'incorporation de méthanethiol, malgré le fait que le méthanethiol est présent dans l'eau de mer à des concentrations beaucoup plus faibles que le sulfate (~ 0,3 nM contre 28 mM). Les bactéries présentes dans des environnements avec et sans oxygène peuvent également convertir le méthanethiol en sulfure de diméthyle (DMS), bien que la plupart des DMS dans l'eau de mer de surface soient produits par une voie distincte. Le DMS et le méthanethiol peuvent tous deux être utilisés par certains microbes comme substrats pour la méthanogenèse dans certains sols anaérobies.
Le méthanethiol est un sous-produit du métabolisme de l' asperge . La production de méthanethiol dans l'urine après avoir mangé des asperges était autrefois considérée comme un trait génétique. Des recherches plus récentes suggèrent que l'odeur particulière est en fait produite par tous les humains après avoir consommé des asperges, alors que la capacité de la détecter (le méthanethiol étant l'un des nombreux composants du «pipi d'asperges») est en fait le trait génétique. Les composants chimiques responsables de la modification de l'odeur de l'urine apparaissent dès 15 minutes après avoir mangé des asperges.
Préparation
Le méthanethiol est préparé dans le commerce par réaction du méthanol avec du sulfure d'hydrogène gazeux sur un catalyseur à l' oxyde d'aluminium :
- CH 3 OH + H 2 S → CH 3 SH + H 2 O
Bien que peu pratique, il peut être préparé par la réaction de l'iodure de méthyle avec la thiourée .
Les usages
Le méthanethiol est principalement utilisé pour produire l'acide aminé essentiel méthionine , qui est utilisé comme composant alimentaire dans la volaille et l'alimentation animale. Le méthanethiol est également utilisé dans l' industrie du plastique comme modérateur pour les polymérisations radicalaires et comme précurseur dans la fabrication de pesticides .
Ce produit chimique est également utilisé dans l' industrie du gaz naturel comme odorant, car il se mélange bien avec le méthane . L'odeur caractéristique «d'œufs pourris» du mélange est largement connue des consommateurs de gaz naturel comme un indicateur d'une éventuelle fuite de gaz , même mineure.
Sécurité
La fiche de données de sécurité (FDS) répertorie le méthanethiol comme un gaz incolore et inflammable avec une odeur extrêmement forte et répulsive. À des concentrations très élevées, il est hautement toxique et affecte le système nerveux central. Son odeur pénétrante prévient les concentrations dangereuses. Un seuil olfactif de 1 ppb a été signalé. La limite de plafond de l' OSHA aux États-Unis est de 10 ppm.