Photo-oxydation des polymères - Photo-oxidation of polymers
En chimie des polymères, la photo-oxydation (parfois : photodégradation oxydante ) est la dégradation d'une surface polymère due à l'action combinée de la lumière et de l'oxygène. C'est le facteur le plus important dans l'altération des plastiques. La photo-oxydation provoque la rupture des chaînes polymères ( scission de chaîne ), ce qui rend le matériau de plus en plus cassant. Cela conduit à une défaillance mécanique et, à un stade avancé, à la formation de microplastiques . Dans les textiles, le processus est appelé phototending .
Des technologies ont été développées pour à la fois accélérer et inhiber ce processus. Par exemple, les composants de construction en plastique comme les portes, les cadres de fenêtres et les gouttières devraient durer des décennies, nécessitant l'utilisation de stabilisateurs UV avancés . A l'inverse, les plastiques à usage unique peuvent être traités avec des additifs biodégradables pour accélérer leur fragmentation. De nombreux pigments et colorants peuvent avoir des effets similaires en raison de leur capacité à absorber l'énergie UV.
Polymères sensibles

PP : polypropylène , PE : polyéthylène , PVC : polychlorure de vinyle , PS : polystyrène , PET : polyéthylène téréphtalate
La sensibilité à la photo-oxydation varie en fonction de la structure chimique du polymère. Certains matériaux ont une excellente stabilité, comme les polymères fluorés , les polyimides , les silicones et certains polymères acrylates . Cependant, la production mondiale de polymères est dominée par une gamme de plastiques de base qui représentent la majorité des déchets plastiques . Parmi ceux-ci, le polyéthylène téréphtalate (PET) n'a qu'une résistance modérée aux UV et les autres, qui comprennent le polystyrène , le polychlorure de vinyle (PVC) et les polyoléfines comme le polypropylène (PP) et le polyéthylène (PE) sont tous très sensibles.
La photo-oxydation est une forme de photodégradation et commence par la formation de radicaux libres sur la chaîne polymère, qui réagissent ensuite avec l'oxygène dans des réactions en chaîne . Pour de nombreux polymères, le mécanisme général d' auto - oxydation est une approximation raisonnable de la chimie sous-jacente. Le processus est autocatalytique , générant un nombre croissant de radicaux et d'espèces réactives de l'oxygène. Ces réactions entraînent des modifications du poids moléculaire (et de la distribution du poids moléculaire ) du polymère et, par conséquent, le matériau devient plus fragile. Le processus général peut être divisé en quatre étapes :
- Initiation du processus de génération du radical libre initial.
- Propagation la conversion d'une espèce active en une autre
- Étapes de ramification de chaîne qui se terminent par la production de plus d'une espèce active. La photolyse des hydroperoxydes en est le principal exemple.
- Étapes de terminaison dans lesquelles les espèces actives sont éliminées, par exemple par dismutation radicale
La photo-oxydation peut se produire simultanément avec d'autres processus comme la dégradation thermique , et chacun d'eux peut accélérer l'autre.
Polyoléfines
Les polyoléfines telles que le polyéthylène et le polypropylène sont sensibles à la photo-oxydation et environ 70 % des stabilisants à la lumière produits dans le monde sont utilisés dans leur protection, bien qu'ils ne représentent qu'environ 50 % de la production mondiale de plastique. Les hydrocarbures aliphatiques ne peuvent adsorber que les rayons UV à haute énergie d'une longueur d'onde inférieure à ~ 250 nm, mais l'atmosphère terrestre et la couche d'ozone filtrent ces rayons, la longueur d'onde minimale normale étant de 280 à 290 nm. La masse du polymère est donc photo-inerte et la dégradation est plutôt attribuée à la présence de diverses impuretés, qui sont introduites lors des étapes de fabrication ou de transformation. Ceux-ci comprennent des groupes hydroperoxyde et carbonyle , ainsi que des sels métalliques tels que des résidus de catalyseur.
Toutes ces espèces agissent comme des photoinitiateurs . Les groupes organiques sont capables d'absorber la lumière UV au-dessus de 290 nm, après quoi ils subissent une photolyse pour générer des radicaux. Les impuretés métalliques agissent comme des photocatalyseurs , bien que de telles réactions puissent être complexes. Il a également été suggéré que des complexes de transfert de charge polymère-O 2 sont impliqués. L'initiation génère des radicaux-carbones sur la chaîne polymère, parfois appelés macroradicaux (P•).
Initiation de la chaîne
Propagation en chaîne
Branchement de chaîne
Résiliation
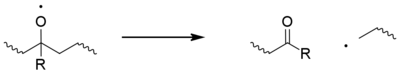
Classiquement, les macroradicaux centrés sur le carbone (P•) réagissent rapidement avec l'oxygène pour former des radicaux hydroperoxyles (POO•), qui à leur tour soustrait un atome H de la chaîne polymère pour donner un hydroperoxyde (POOH) et un macroradical frais. Les hydroperoxydes subissent facilement une photolyse pour donner un radical macroradical alcoxy (PO•) et un radical hydroxyle (HO•), qui peuvent tous deux former de nouveaux radicaux polymères par abstraction d'hydrogène. Des alternatives non classiques à ces étapes ont été proposées. Le radical alcoxy peut également subir une scission bêta , générant une acyl- cétone et un macroradical. Ceci est considéré comme la principale cause de rupture de chaîne en polypropylène.
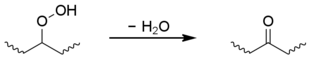
Les hydroperoxydes secondaires peuvent également subir une réaction intramoléculaire pour donner un groupe cétone, bien que cela soit limité au polyéthylène.
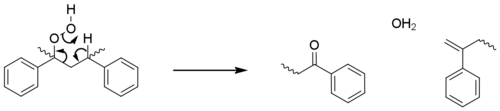
Les cétones générées par ces processus sont elles-mêmes photo-actives, bien que beaucoup plus faiblement. A température ambiante, ils subissent des réactions de Norrish de type II avec coupure de chaîne. Ils peuvent également absorber l'énergie UV, qu'ils peuvent ensuite transférer à O 2 , le faisant entrer dans son état triplet hautement réactif . L'oxygène triplet est un agent oxydant puissant qui peut continuer à se former et à provoquer une dégradation supplémentaire.
polystyrène
Pour le polystyrène, le mécanisme complet de la photo-oxydation est encore un sujet de débat, car différentes voies peuvent fonctionner simultanément et varier en fonction de la longueur d'onde de la lumière incidente. Quoi qu'il en soit, il y a un accord sur les grandes étapes.
Le polystyrène pur ne devrait pas être capable d'absorber la lumière avec une longueur d'onde inférieure à ~ 280 nm et l'initiation est expliquée par des impuretés photolabiles (hydroperoxydes) et des complexes de transfert de charge, qui sont tous capables d'absorber la lumière solaire normale. Les complexes de transfert de charge d'oxygène et de groupes polystyrène phényle absorbent la lumière pour former de l'oxygène singulet , qui agit comme un initiateur de radicaux. Les impuretés carbonylées dans le polymère (cf acétophénone ) absorbent également la lumière dans le proche ultraviolet (300 à 400 nm), formant des cétones excitées capables d'extraire des atomes d'hydrogène directement du polymère. L'hydroperoxyde subit une photolyse pour former des radicaux hydroxyle et alcoxyle.
Ces étapes d'initiation génèrent des macroradicaux sur les sites tertiaires, car ceux-ci sont plus stabilisés. Les étapes de propagation sont sensiblement identiques à celles observées pour les polyoléfines ; avec oxydation, abstraction d'hydrogène et photolyse conduisant à des réactions de scission bêta et à un nombre croissant de radicaux. Ces étapes représentent la majorité de la rupture de chaîne, mais dans une voie mineure, l'hydroperoxyde réagit directement avec le polymère pour former un groupe cétone ( acétophénone ) et un alcène terminal sans formation de radicaux supplémentaires.
Le polystyrène jaunit pendant la photo-oxydation, ce qui est attribué à la formation de polyènes à partir de ces alcènes terminaux.
Chlorure de polyvinyle - (PVC)
Les organochlorures comme le polychlorure de vinyle (PVC) n'absorbent pas la lumière au-dessus de 220 nm. L'initiation de la photo-oxydation est plutôt causée par divers groupes, y compris des irrégularités ou des défauts dans la chaîne polymère ainsi que des hydroperoxydes, des groupes carbonyle et des doubles liaisons. Les hydroperoxydes formés pendant le traitement sont l'initiateur le plus important pour commencer, mais leur concentration diminue pendant la photo-oxydation tandis que la concentration en carbonyle augmente, car ces carbonyles peuvent devenir l'initiateur principal au fil du temps.
Les étapes de propagation impliquent le radical hydroperoxyle, qui peut extraire l'hydrogène des sites hydrocarbonés (-CH 2 -) et organochlorés (-CH 2 Cl-) dans le polymère à des vitesses comparables. Les radicaux formés sur les sites d'hydrocarbures se transforment rapidement en alcènes avec perte de chlore radical. Cela forme des hydrogènes allyliques (indiqués en rouge) qui sont plus sensibles à l'abstraction d'hydrogène conduisant à la formation de polyènes dans des réactions de type fermeture éclair.
Lorsque les polyènes contiennent au moins huit doubles liaisons conjuguées, ils se colorent, entraînant un jaunissement et un brunissement éventuel du matériau. Ceci est légèrement compensé par le photoblanchiment des polyènes plus longs avec de l'oxygène atmosphérique, mais le PVC finit par se décolorer à moins que des stabilisants polymères ne soient présents. Les réactions au niveau des sites organochlorés se déroulent via l'hydroperoxyle et l'hydroperoxyde habituels avant que la photolyse ne donne le radical chloro-chloro-alcoxyle. Cette espèce peut subir diverses réactions pour donner des carbonyles, des réticulations de peroxyde et des produits de scission bêta.

Poly(éthylène téréphtalate) - (PET)
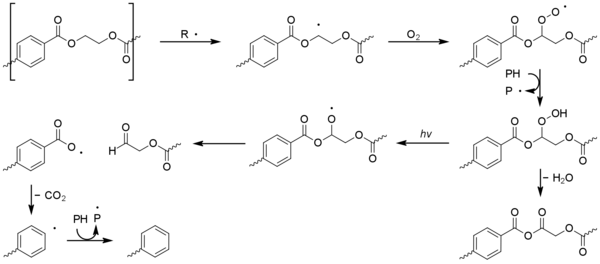
Contrairement à la plupart des autres matières plastiques, le polyéthylène téréphtalate (PET) est capable d'absorber les rayons ultraviolets proches de la lumière du soleil. L'absorption commence à 360 nm, devient plus forte en dessous de 320 nm et est très importante en dessous de 300 nm. Malgré cela, le PET a une meilleure résistance à la photo-oxydation que les autres plastiques de base , cela est dû à un faible rendement quantique . La chimie de dégradation est compliquée en raison des réactions simultanées de photodissociation (c'est-à-dire sans oxygène) et de photo-oxydation des parties aromatique et aliphatique de la molécule. La scission de chaîne est le processus dominant, la ramification des chaînes et la formation d'impuretés colorées étant moins courantes. Le monoxyde de carbone, le dioxyde de carbone et les acides carboxyliques sont les principaux produits. La photo-oxydation d'autres polyesters linéaires tels que le téréphtalate de polybutylène et le naphtalate de polyéthylène se déroule de manière similaire.
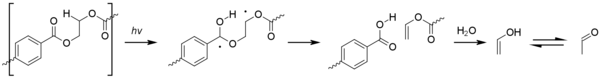
La photodissociation implique la formation d'une unité d' acide téréphtalique excitée qui subit des réactions de Norrish . La réaction de type I domine, ce qui provoque une scission de chaîne au niveau de l'unité carbonyle pour donner une gamme de produits.
Les réactions de Norrish de type II sont moins courantes mais donnent naissance à de l' acétaldéhyde au moyen d'esters d'alcool vinylique. Cela a un seuil d'odeur et de goût extrêmement bas et peut provoquer un mauvais goût dans l'eau en bouteille.
Les radicaux formés par photolyse peuvent initier la photo-oxydation dans le PET. La photo-oxydation du noyau d' acide téréphtalique aromatique entraîne son oxydation par étapes en acide 2,5-dihydroxytéréphtalique. Le processus de photo-oxydation au niveau des sites aliphatiques est similaire à celui observé pour les polyoléfines, avec la formation d'espèces hydroperoxyde conduisant finalement à une bêta-scission de la chaîne polymère.
Facteurs secondaires
Environnement
Peut-être étonnamment, l'effet de la température est souvent plus important que l'effet de l'exposition aux UV. Cela peut être vu en termes de l' équation d'Arrhenius , qui montre que les vitesses de réaction ont une dépendance exponentielle de la température. Par comparaison, la dépendance du taux de dégradation sur l'exposition aux UV et la disponibilité de l'oxygène est largement linéaire. Comme les océans sont plus froids que les terres, la pollution plastique du milieu marin se dégrade plus lentement. Les matériaux enfouis dans les décharges ne se dégradent pas du tout par photo-oxydation, bien qu'ils puissent se dégrader progressivement par d'autres processus.
Le stress mécanique peut affecter le taux de photo-oxydation et peut également accélérer la rupture physique des objets en plastique. Les contraintes peuvent être causées par des charges mécaniques (contraintes de traction et de cisaillement) ou même par des cycles de température , en particulier dans les systèmes composites constitués de matériaux avec des coefficients de dilatation thermique différents . De même, des précipitations soudaines peuvent provoquer un stress thermique .
Effets des colorants/pigments
Les colorants et les pigments sont utilisés dans les matériaux polymères pour donner de la couleur, mais ils peuvent également affecter le taux de photo-oxydation. Beaucoup absorbent les rayons UV et protègent ainsi le polymère, mais l'absorption peut faire entrer les colorants dans un état excité où ils peuvent attaquer le polymère ou transférer de l'énergie à l'O 2 pour former de l'oxygène singulet dommageable . La Cu-phtalocyanine est un exemple, elle absorbe fortement la lumière UV, cependant la Cu-phtalocyanine excitée peut agir comme un photoinitiateur en extrayant les atomes d'hydrogène du polymère. Ses interactions peuvent devenir encore plus compliquées lorsque d'autres additifs sont présents. De même, le noir de carbone filtre la lumière UV mais augmente considérablement la quantité d'énergie thermique absorbée par le plastique.
Additifs pour améliorer la dégradation
Des additifs biodégradables peuvent être ajoutés aux polymères pour accélérer leur dégradation. Dans le cas de la photo-oxydation, des additifs de biodégradation OXO sont utilisés. Ce sont des sels de métaux de transition tels que le fer (Fe) , le manganèse (Mn) et le cobalt (Co) . Les complexes de Fe augmentent la vitesse de photooxydation en favorisant l' homolyse des hydroperoxydes via les réactions de Fenton .
L'utilisation de tels additifs a été controversée en raison des préoccupations selon lesquelles les plastiques traités ne se biodégradent pas complètement et entraînent plutôt la formation accélérée de microplastiques . Les oxoplastiques seraient difficiles à distinguer du plastique non traité, mais leur inclusion lors du recyclage du plastique peut créer un produit déstabilisé avec moins d'utilisations potentielles, mettant potentiellement en péril l'analyse de rentabilisation du recyclage de tout plastique. Les additifs de biodégradation OXO ont été interdits dans l'UE en 2019
La prévention
L'attaque des UV par la lumière du soleil peut être améliorée ou empêchée en ajoutant des stabilisants polymères anti-UV , généralement avant la mise en forme du produit par moulage par injection . Les stabilisateurs UV dans les plastiques agissent généralement en absorbant préférentiellement le rayonnement UV et en dissipant l'énergie sous forme de chaleur de faible niveau. Les produits chimiques utilisés sont similaires à ceux des produits solaires , qui protègent la peau des agressions des UV. Ils sont fréquemment utilisés dans les plastiques , y compris les cosmétiques et les films . Différents stabilisateurs UV sont utilisés en fonction du substrat, de la durée de vie fonctionnelle prévue et de la sensibilité à la dégradation par les UV. Les stabilisants UV, tels que les benzophénones , agissent en absorbant le rayonnement UV et en empêchant la formation de radicaux libres . En fonction de la substitution, le spectre d'absorption UV est modifié pour correspondre à l'application. Les concentrations varient normalement de 0,05 % à 2 %, avec certaines applications jusqu'à 5 %.
Souvent, le verre peut être une meilleure alternative aux polymères en ce qui concerne la dégradation par les UV. La plupart des types de verre couramment utilisés sont très résistants aux rayons UV. Les lampes de protection contre les explosions pour les plates-formes pétrolières par exemple peuvent être en polymère ou en verre. Ici, le rayonnement UV et les intempéries sollicitent tellement le polymère que le matériau doit être remplacé fréquemment.
Le poly(éthylène-naphtalate) (PEN) peut être protégé en appliquant un revêtement d'oxyde de zinc, qui agit comme un film protecteur réduisant la diffusion de l'oxygène. L'oxyde de zinc peut également être utilisé sur du polycarbonate (PC) pour diminuer le taux d'oxydation et de photo-jaunissement causé par le rayonnement solaire.
Analyse
Essais météorologiques des polymères
La photo-oxydation des polymères peut être étudiée par des essais climatiques naturels ou accélérés. De tels tests sont importants pour déterminer la durée de vie attendue des articles en plastique ainsi que le devenir des déchets plastiques .
Détection
La dégradation peut être détectée avant que de sérieuses fissures ne soient observées dans un produit à l'aide de la spectroscopie infrarouge . En particulier, les espèces peroxy et les groupes carbonyle formés par photo-oxydation ont des bandes d'absorption distinctes.
Dans l'exemple illustré à gauche, les groupes carbonyle ont été facilement détectés par spectroscopie IR à partir d'un film mince coulé. Le produit était un cône routier réalisé par rotomoulage en LDPE , qui s'était fissuré prématurément en service. De nombreux cônes similaires ont également échoué car un additif anti-UV n'avait pas été utilisé pendant le traitement. Parmi les autres produits en plastique qui ont échoué, citons les cabines de conduite en polypropylène utilisées sur les chantiers routiers qui se sont fissurées après quelques mois d'entretien seulement.
Voir également
- Dégradation des polymères
- Photodégradation
- Dégradation thermique des polymères
- Ingénierie judiciaire des polymères
- Fissuration par corrosion