Cellule artificielle - Artificial cell
Une cellule artificielle , une cellule synthétique ou une cellule minimale est une particule modifiée qui imite une ou plusieurs fonctions d'une cellule biologique . Souvent, les cellules artificielles sont des membranes biologiques ou polymères qui renferment des matériaux biologiquement actifs. A ce titre, les liposomes , les polymersomes , les nanoparticules , les microcapsules et un certain nombre d'autres particules peuvent être qualifiées de cellules artificielles.
Les termes « cellule artificielle » et « cellule synthétique » sont utilisés dans une variété de domaines différents et peuvent avoir des significations différentes, comme cela est également reflété dans les différentes sections de cet article. Certaines définitions plus strictes reposent sur l'hypothèse que le terme « cellule » se rapporte directement aux cellules biologiques et que ces structures doivent donc être vivantes et, en outre, que le terme « artificiel » implique que ces structures sont artificiellement construites de bas en haut. , c'est-à-dire à partir de composants de base. En tant que telle, dans le domaine de la biologie synthétique , une cellule artificielle peut être comprise comme une cellule entièrement synthétique qui peut capturer de l' énergie , maintenir des gradients d'ions , contenir des macromolécules ainsi que stocker des informations et avoir la capacité de se répliquer . Ce type de cellule artificielle n'a pas encore été fabriqué.
Cependant, dans d'autres cas, le terme « artificiel » n'implique pas que toute la structure est artificielle, mais peut plutôt faire référence à l'idée que certaines fonctions ou structures de cellules biologiques peuvent être remplacées ou complétées par une entité synthétique.
Dans d'autres domaines, le terme "cellule artificielle" peut se référer à n'importe quel compartiment qui ressemble quelque peu à une cellule biologique par sa taille ou sa structure, qui est fabriqué synthétiquement, ou même entièrement fabriqué à partir de composants non biologiques. Le terme "cellule artificielle" est également utilisé pour des structures avec des applications directes telles que des compartiments pour l'administration de médicaments. La micro-encapsulation permet le métabolisme à l'intérieur de la membrane, l'échange de petites molécules et la prévention du passage de grosses substances à travers celle-ci. Les principaux avantages de l'encapsulation comprennent un meilleur mimétisme dans le corps, une solubilité accrue de la cargaison et une diminution des réponses immunitaires . Notamment, les cellules artificielles ont été cliniquement efficaces dans l' hémoperfusion .
| Fait partie d'une série d'articles sur |
| La biologie de synthèse |
|---|
| Circuits biologiques synthétiques |
| Édition du génome |
| Cellules artificielles |
| Xénobiologie |
| Autres sujets |
Ingénierie ascendante de cellules artificielles vivantes
Le pathologiste allemand Rudolf Virchow a avancé l'idée que non seulement la vie naît des cellules, mais que chaque cellule vient d'une autre cellule ; " Omnis cellula e cellula ". Jusqu'à présent, la plupart des tentatives de création d'une cellule artificielle n'ont créé qu'un package pouvant imiter certaines tâches de la cellule. Les progrès dans les réactions de transcription et de traduction acellulaires permettent l'expression de nombreux gènes , mais ces efforts sont loin de produire une cellule pleinement opérationnelle.
Un bottom-up approche pour construire une cellule artificielle impliquerait la création d' un protocellule de novo , entièrement à partir de matières non vivantes. Comme le terme "cellule" l'implique, une condition préalable est la génération d'une sorte de compartiment qui définit une unité cellulaire individuelle. Les membranes phospholipidiques sont un choix évident en tant que frontières de compartimentation, car elles agissent comme des barrières sélectives dans toutes les cellules biologiques vivantes. Les scientifiques peuvent encapsuler des biomolécules dans des vésicules phospholipidiques de la taille d'une cellule et, ce faisant, observer ces molécules agir de la même manière que dans les cellules biologiques et ainsi recréer certaines fonctions cellulaires. De manière similaire, des briques biologiques fonctionnelles peuvent être encapsulées dans ces compartiments lipidiques pour réaliser la synthèse de cellules artificielles (quoique rudimentaires).
Il est proposé de créer une vésicule bicouche phospholipidique avec un ADN capable de s'auto-reproduire à l'aide d'informations génétiques synthétiques. Les trois éléments principaux de ces cellules artificielles sont la formation d'une membrane lipidique , la réplication de l' ADN et de l' ARN via un processus de matrice et la récolte d'énergie chimique pour un transport actif à travers la membrane. Les principaux obstacles prévus et rencontrés avec cette protocellule proposée sont la création d'un ADN synthétique minimal qui contient toutes les informations suffisantes pour la vie et la reproduction de composants non génétiques faisant partie intégrante du développement cellulaire, tels que l'auto-organisation moléculaire. Cependant, on espère que ce type d'approche ascendante permettra de mieux comprendre les questions fondamentales des organisations au niveau cellulaire et les origines de la vie biologique. Jusqu'à présent, aucune cellule complètement artificielle capable de s'auto-reproduire n'a été synthétisée à l'aide des molécules du vivant, et cet objectif est encore dans un avenir lointain bien que divers groupes travaillent actuellement dans ce sens.
Une autre méthode proposée pour créer une protocellule ressemble plus aux conditions qui auraient été présentes au cours de l'évolution, connue sous le nom de soupe primordiale. Divers polymères d'ARN pourraient être encapsulés dans des vésicules et dans des conditions limites si petites, des réactions chimiques seraient testées.
Éthique et controverse
La recherche Protocell a créé une controverse et des opinions opposées, y compris des critiques de la vague définition de « vie artificielle ». La création d'une unité vitale de base est la préoccupation éthique la plus pressante, bien que la préoccupation la plus répandue concernant les protocellules soit leur menace potentielle pour la santé humaine et l'environnement par une réplication incontrôlée.
Communauté de recherche internationale
Au milieu des années 2010, la communauté des chercheurs a commencé à reconnaître la nécessité d'unifier le domaine de la recherche sur les cellules synthétiques, reconnaissant que la tâche de construire un organisme vivant entier à partir de composants non vivants dépassait les ressources d'un seul pays.
En 2017, la collaboration internationale de recherche à grande échelle Build-a-Cell pour la construction de cellules vivantes synthétiques a été lancée, suivie par des organisations nationales de cellules synthétiques dans plusieurs pays. Ces organisations nationales comprennent FabriCell, MaxSynBio et BaSyC. Les efforts européens sur les cellules synthétiques ont été unifiés en 2019 en tant qu'initiative SynCellEU.
Approche descendante pour créer une cellule vivante minimale
Les membres de l' Institut J. Craig Venter ont utilisé une approche informatique descendante pour éliminer les gènes d'un organisme vivant en un ensemble minimum de gènes. En 2010, l'équipe a réussi à créer une souche de réplication de Mycoplasma mycoides ( Mycoplasma laboratorium ) en utilisant un ADN synthétiquement créé considéré comme le minimum requis pour la vie qui a été inséré dans une bactérie génomiquement vide. On espère que le processus de biosynthèse descendante permettra l'insertion de nouveaux gènes qui rempliraient des fonctions rentables telles que la génération d'hydrogène comme carburant ou la capture de l'excès de dioxyde de carbone dans l'atmosphère. La myriade de réseaux de régulation, métaboliques et de signalisation ne sont pas complètement caractérisés. Ces approches descendantes ont des limites pour la compréhension de la régulation moléculaire fondamentale, car les organismes hôtes ont une composition moléculaire complexe et incomplètement définie. En 2019, un modèle informatique complet de toutes les voies dans la cellule Mycoplasma Syn3.0 a été publié, représentant le premier modèle in silico complet pour un organisme minimal vivant.
De gros investissements dans la biologie ont été réalisés par de grandes entreprises telles qu'ExxonMobil , qui s'est associée à Synthetic Genomics Inc ; La propre société de biosynthèse de Craig Venter dans le développement de carburant à partir d'algues.
Depuis 2016, Mycoplasma genitalium est le seul organisme utilisé comme point de départ pour concevoir une cellule minimale, car il possède le plus petit génome connu pouvant être cultivé dans des conditions de laboratoire ; la variété de type sauvage en a 482, et la suppression d'exactement 100 gènes jugés non essentiels a donné une souche viable avec des taux de croissance améliorés. Escherichia coli à génome réduit est considéré comme plus utile, et des souches viables ont été développées avec 15 % du génome supprimé.
Une variante d'une cellule artificielle a été créée dans laquelle un génome entièrement synthétique a été introduit dans des cellules hôtes génomiquement vidées. Bien qu'elle ne soit pas complètement artificielle car les composants cytoplasmiques ainsi que la membrane de la cellule hôte sont conservés, la cellule modifiée est sous le contrôle d'un génome synthétique et est capable de se répliquer .
Cellules artificielles pour applications médicales
Histoire
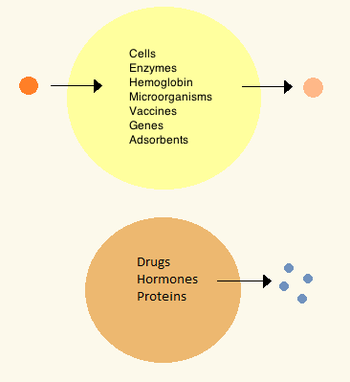
Dans les années 1960, Thomas Chang a développé des microcapsules qu'il appellera plus tard « cellules artificielles », car il s'agissait de compartiments de la taille d'une cellule fabriqués à partir de matériaux artificiels. Ces cellules étaient constituées de membranes ultrafines de nylon, de collodion ou de protéines réticulées dont les propriétés semi-perméables permettaient la diffusion de petites molécules à l'intérieur et à l'extérieur de la cellule. Ces cellules étaient de la taille d'un micron et contenaient des cellules , des enzymes , de l' hémoglobine , des matériaux magnétiques, des adsorbants et des protéines .
Plus tard, les cellules artificielles ont des dimensions allant de la centaine de micromètres au nanomètre et peuvent transporter des micro-organismes, des vaccins , des gènes , des médicaments, des hormones et des peptides . La première utilisation clinique des cellules artificielles a été en hémoperfusion par encapsulation de charbon actif .
Dans les années 1970, les chercheurs ont réussi à introduire des enzymes, des protéines et des hormones dans des microcapsules biodégradables, conduisant plus tard à une utilisation clinique dans des maladies telles que le syndrome de Lesch-Nyhan . Bien que les recherches initiales de Chang se soient concentrées sur les globules rouges artificiels , ce n'est qu'au milieu des années 1990 que des globules rouges artificiels biodégradables ont été développés. Les cellules artificielles dans l'encapsulation de cellules biologiques ont été utilisées pour la première fois en clinique en 1994 pour le traitement d'un patient diabétique et depuis lors, d'autres types de cellules telles que les hépatocytes , les cellules souches adultes et les cellules génétiquement modifiées ont été encapsulées et sont à l'étude pour une utilisation dans la régénération tissulaire. .
Matériaux
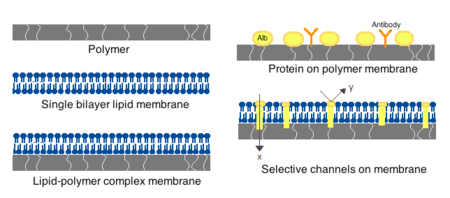
Les membranes pour cellules artificielles peuvent être constituées de polymères simples , de protéines réticulées, de membranes lipidiques ou de complexes polymère-lipide. En outre, les membranes peuvent être conçues pour présenter des protéines de surface telles que l' albumine , des antigènes , des transporteurs de Na/K-ATPase ou des pores tels que des canaux ioniques . Les matériaux couramment utilisés pour la production de membranes comprennent les polymères hydrogels tels que l' alginate , la cellulose et les polymères thermoplastiques tels que le méthacrylate d'hydroxyéthyle-méthacrylate de méthyle (HEMA-MMA), le polyacrylonitrile-chlorure de polyvinyle (PAN-PVC), ainsi que des variantes de ce qui précède. mentionné. Le matériau utilisé détermine la perméabilité de la membrane cellulaire, qui pour le polymère dépend de la coupure de poids moléculaire (MWCO). Le MWCO est le poids moléculaire maximal d'une molécule qui peut passer librement à travers les pores et est important pour déterminer la diffusion adéquate des nutriments, des déchets et d'autres molécules critiques. Les polymères hydrophiles ont le potentiel d'être biocompatibles et peuvent être fabriqués sous diverses formes, notamment des micelles polymères , des mélanges sol-gel , des mélanges physiques et des particules et nanoparticules réticulées. Les polymères sensibles aux stimuli qui répondent aux changements de pH ou de température sont particulièrement intéressants pour une utilisation dans une administration ciblée. Ces polymères peuvent être administrés sous forme liquide par injection macroscopique et se solidifier ou se gélifier in situ en raison de la différence de pH ou de température. Des préparations de nanoparticules et de liposomes sont également couramment utilisées pour l'encapsulation et la délivrance de matériaux. Un avantage majeur des liposomes est leur capacité à fusionner avec les membranes des cellules et des organites .
Préparation
De nombreuses variantes pour la préparation et l'encapsulation de cellules artificielles ont été développées. Typiquement, des vésicules telles qu'une nanoparticule , un polymersome ou un liposome sont synthétisées. Une émulsion est généralement réalisée à l'aide d'un équipement haute pression tel qu'un homogénéisateur haute pression ou un microfluidiseur . Deux méthodes de micro-encapsulation de la nitrocellulose sont également décrites ci-dessous.
Homogénéisation haute pression
Dans un homogénéisateur haute pression, deux liquides en suspension huile/liquide sont forcés à travers un petit orifice sous très haute pression. Ce processus divise les produits et permet la création de particules extrêmement fines, aussi petites que 1 nm.
Microfluidisation
Cette technique utilise un microfluidiseur breveté pour obtenir une plus grande quantité de suspensions homogènes pouvant créer des particules plus petites que les homogénéisateurs. Un homogénéisateur est d'abord utilisé pour créer une suspension grossière qui est ensuite pompée dans le microfluidiseur sous haute pression. Le flux est ensuite divisé en deux flux qui réagiront à des vitesses très élevées dans une chambre d'interaction jusqu'à ce que la granulométrie souhaitée soit obtenue. Cette technique permet la production à grande échelle de liposomes phospholipidiques et les nanoencapsulations de matériaux ultérieures.
Méthode de dépôt
Dans cette méthode, une solution cellulaire est incorporée goutte à goutte dans une solution de collodion de nitrate de cellulose. Au fur et à mesure que la goutte traverse le collodion, elle est recouverte d'une membrane grâce aux propriétés de polymérisation interfaciale du collodion. La cellule se dépose plus tard dans la paraffine où la membrane se fixe et est finalement mise en suspension dans une solution saline. La méthode de la goutte est utilisée pour la création de grandes cellules artificielles qui encapsulent des cellules biologiques, des cellules souches et des cellules souches génétiquement modifiées.
Méthode d'émulsion
La méthode de l' émulsion diffère en ce que le matériau à encapsuler est généralement plus petit et est placé au fond d'une chambre de réaction où le collodion est ajouté sur le dessus et centrifugé, ou autrement perturbé afin de créer une émulsion. Le matériau encapsulé est ensuite dispersé et mis en suspension dans une solution saline.
Pertinence clinique
Libération et livraison de médicaments
Les cellules artificielles utilisées pour l'administration de médicaments diffèrent des autres cellules artificielles car leur contenu est destiné à diffuser hors de la membrane ou à être englouti et digéré par une cellule cible hôte. Les cellules artificielles à membrane lipidique submicroniques sont souvent utilisées et peuvent être appelées nanocapsules, nanoparticules, polymersomes ou d'autres variantes du terme.
Thérapie enzymatique
La thérapie enzymatique est activement étudiée pour les maladies métaboliques génétiques où une enzyme est surexprimée, sous-exprimée, défectueuse ou pas du tout présente. En cas de sous-expression ou d'expression d'une enzyme défectueuse , une forme active de l'enzyme est introduite dans l'organisme pour compenser le déficit. D'autre part, une surexpression enzymatique peut être contrecarrée par l'introduction d'une enzyme non fonctionnelle concurrente ; c'est-à-dire une enzyme qui métabolise le substrat en produits non actifs. Lorsqu'elles sont placées dans une cellule artificielle, les enzymes peuvent remplir leur fonction pendant une période beaucoup plus longue que les enzymes libres et peuvent être optimisées davantage par la conjugaison de polymères.
La première enzyme étudiée sous encapsulation cellulaire artificielle était l' asparaginase pour le traitement du lymphosarcome chez la souris. Ce traitement a retardé l'apparition et la croissance de la tumeur . Ces premières découvertes ont conduit à d'autres recherches sur l'utilisation de cellules artificielles pour l'administration d'enzymes dans les mélanomes tyrosine- dépendants . Ces tumeurs ont une plus grande dépendance à la tyrosine que les cellules normales pour la croissance, et la recherche a montré que l'abaissement des niveaux systémiques de tyrosine chez la souris peut inhiber la croissance des mélanomes. L'utilisation de cellules artificielles dans l'administration de tyrosinase ; et une enzyme qui digère la tyrosine, permet une meilleure stabilité enzymatique et s'avère efficace dans l'élimination de la tyrosine sans les effets secondaires graves associés à la dépravation de la tyrosine dans l'alimentation.
La thérapie enzymatique cellulaire artificielle présente également un intérêt pour l'activation de promédicaments tels que l' ifosfamide dans certains cancers. Les cellules artificielles encapsulant l' enzyme cytochrome p450 qui convertit ce promédicament en médicament actif peuvent être adaptées pour s'accumuler dans le carcinome pancréatique ou implanter les cellules artificielles à proximité du site tumoral. Ici, la concentration locale de l'ifosfamide activé sera beaucoup plus élevée que dans le reste du corps empêchant ainsi la toxicité systémique . Le traitement a été efficace chez les animaux et a montré un doublement des survies médianes chez les patients atteints d' un cancer du pancréas à un stade avancé dans les essais cliniques de phase I/II, et un triplement du taux de survie à un an.
Thérapie génique
Dans le traitement des maladies génétiques, la thérapie génique vise à insérer, modifier ou supprimer des gènes dans les cellules d'un individu atteint. La technologie repose fortement sur des vecteurs viraux, ce qui soulève des inquiétudes quant à la mutagenèse insertionnelle et à la réponse immunitaire systémique qui ont conduit à la mort de l'homme et au développement de la leucémie dans les essais cliniques. Contourner le besoin de vecteurs en utilisant de l'ADN nu ou plasmidique comme son propre système d'administration rencontre également des problèmes tels qu'une faible efficacité de transduction et un mauvais ciblage des tissus lorsqu'il est administré de manière systémique.
Des cellules artificielles ont été proposées comme vecteur non viral par lequel des cellules non autologues génétiquement modifiées sont encapsulées et implantées pour délivrer des protéines recombinantes in vivo . Ce type d' immuno-isolement s'est avéré efficace chez la souris grâce à l'administration de cellules artificielles contenant de l'hormone de croissance de souris qui a permis de remédier à un retard de croissance chez les souris mutantes. Quelques stratégies ont avancé jusqu'aux essais cliniques humains pour le traitement du cancer du pancréas , de la sclérose latérale et du contrôle de la douleur.
Hémoperfusion
La première utilisation clinique des cellules artificielles a été en hémoperfusion par encapsulation de charbon actif . Le charbon actif a la capacité d'adsorber de nombreuses grosses molécules et est connu depuis longtemps pour sa capacité à éliminer les substances toxiques du sang en cas d'empoisonnement accidentel ou de surdosage. Cependant, la perfusion par administration directe de charbon de bois est toxique car elle conduit à des embolies et à des lésions des cellules sanguines suivies d'une élimination par les plaquettes. Les cellules artificielles permettent aux toxines de se diffuser dans la cellule tout en gardant la cargaison dangereuse dans leur membrane ultrafine.
L' hémoperfusion cellulaire artificielle a été proposée comme une option de détoxification moins coûteuse et plus efficace que l' hémodialyse , dans laquelle la filtration du sang n'a lieu que par séparation granulométrique par une membrane physique. Dans l'hémoperfusion, des milliers de cellules artificielles adsorbantes sont retenues à l'intérieur d'un petit récipient grâce à l'utilisation de deux écrans à chaque extrémité à travers lesquels le sang du patient perfuse . Au fur et à mesure que le sang circule, des toxines ou des médicaments se diffusent dans les cellules et sont retenus par le matériau absorbant. Les membranes des cellules artificielles sont beaucoup plus fines que celles utilisées en dialyse et leur petite taille leur confère une surface membranaire élevée . Cela signifie qu'une partie de la cellule peut avoir un transfert de masse théorique cent fois supérieur à celui d'un rein artificiel entier. Le dispositif a été établi comme une méthode clinique de routine pour les patients traités pour une intoxication accidentelle ou suicidaire, mais a également été introduit comme thérapie dans l'insuffisance hépatique et l' insuffisance rénale en réalisant une partie de la fonction de ces organes. L'hémoperfusion de cellules artificielles a également été proposée pour une utilisation dans l'immunoadsorption par laquelle les anticorps peuvent être éliminés du corps en fixant un matériau immunoadsorbant tel que l' albumine sur la surface des cellules artificielles. Ce principe a été utilisé pour éliminer les anticorps des groupes sanguins du plasma pour la transplantation de moelle osseuse et pour le traitement de l' hypercholestérolémie grâce à des anticorps monoclonaux pour éliminer les lipoprotéines de basse densité . L'hémoperfusion est particulièrement utile dans les pays où l'industrie de fabrication d'hémodialyse est faible, car les dispositifs y sont généralement moins chers et utilisés chez les patients atteints d' insuffisance rénale .
Cellules encapsulées
La méthode la plus courante de préparation de cellules artificielles est l'encapsulation cellulaire . Les cellules encapsulées sont généralement obtenues grâce à la génération de gouttelettes de taille contrôlée à partir d'une suspension cellulaire liquide qui sont ensuite rapidement solidifiées ou gélifiées pour fournir une stabilité supplémentaire. La stabilisation peut être obtenue par un changement de température ou par réticulation du matériau. Le microenvironnement qu'une cellule voit change lors de l'encapsulation. Il passe généralement d'une monocouche à une suspension dans un échafaudage polymère à l'intérieur d'une membrane polymère. Un inconvénient de la technique est que l'encapsulation d'une cellule diminue sa viabilité et sa capacité à proliférer et à se différencier. De plus, après un certain temps à l'intérieur de la microcapsule, les cellules forment des amas qui inhibent l'échange d'oxygène et de déchets métaboliques, conduisant à l' apoptose et à la nécrose limitant ainsi l'efficacité des cellules et activant le système immunitaire de l'hôte . Les cellules artificielles ont réussi à transplanter un certain nombre de cellules, notamment des îlots de Langerhans pour le traitement du diabète , des cellules parathyroïdiennes et des cellules du cortex surrénalien.
Hépatocytes encapsulés
La pénurie de donneurs d'organes fait des cellules artificielles des acteurs clés des thérapies alternatives pour l'insuffisance hépatique . L'utilisation de cellules artificielles pour la transplantation d' hépatocytes a démontré la faisabilité et l'efficacité de la fonction hépatique dans des modèles de maladie hépatique animale et de dispositifs hépatiques bioartificiels . La recherche est issue d'expériences dans lesquelles les hépatocytes étaient attachés à la surface d'un micro-support et ont évolué en hépatocytes qui sont encapsulés dans une matrice tridimensionnelle dans des microgouttelettes d' alginate recouvertes d'une peau externe de polylysine . Un avantage clé de cette méthode d'administration est le contournement du traitement immunosuppresseur pendant la durée du traitement. Des encapsulations d'hépatocytes ont été proposées pour une utilisation dans un foie bioartificiel . Le dispositif consiste en une chambre cylindrique incrustée d'hépatocytes isolés à travers lesquels le plasma du patient circule de manière extracorporelle dans un type d' hémoperfusion . Étant donné que les microcapsules ont une grande surface à volume de rapport, ils fournissent surface large pour la diffusion de substrat et peut accueillir un grand nombre d'hépatocytes. Le traitement des souris souffrant d'insuffisance hépatique induite a montré une augmentation significative du taux de survie. Les systèmes hépatiques artificiels sont encore à leurs débuts, mais présentent un potentiel pour les patients en attente d' une greffe d'organe ou pendant que le foie d'un patient se régénère suffisamment pour reprendre une fonction normale. Jusqu'à présent, les essais cliniques utilisant des systèmes hépatiques artificiels et la transplantation d'hépatocytes dans les maladies du foie en phase terminale ont montré une amélioration des marqueurs de santé, mais n'ont pas encore amélioré la survie. La courte longévité et l'agrégation des hépatocytes artificiels après transplantation sont les principaux obstacles rencontrés. Les hépatocytes co-encapsulés avec des cellules souches présentent une plus grande viabilité en culture et après implantation et implantation de cellules souches artificielles seules ont également montré une régénération hépatique. Ainsi, l'utilisation de cellules souches pour l'encapsulation en médecine régénérative s'est intéressée .
Cellules bactériennes encapsulées
L'ingestion orale de colonies de cellules bactériennes vivantes a été proposée et est actuellement en thérapie pour la modulation de la microflore intestinale , la prévention des maladies diarrhéiques , le traitement des infections à H. Pylori , les inflammations atopiques, l'intolérance au lactose et la modulation immunitaire , entre autres. Le mécanisme d'action proposé n'est pas entièrement compris, mais on pense qu'il a deux effets principaux. Le premier est l'effet nutritionnel, dans lequel les bactéries entrent en compétition avec les bactéries productrices de toxines. Le second est l'effet sanitaire, qui stimule la résistance à la colonisation et stimule la réponse immunitaire . L'administration orale de cultures bactériennes est souvent un problème car elles sont ciblées par le système immunitaire et souvent détruites lorsqu'elles sont prises par voie orale. Les cellules artificielles aident à résoudre ces problèmes en fournissant un mimétisme dans le corps et une libération sélective ou à long terme, augmentant ainsi la viabilité des bactéries atteignant le système gastro - intestinal . De plus, l'encapsulation de cellules bactériennes vivantes peut être conçue pour permettre la diffusion de petites molécules comprenant des peptides dans le corps à des fins thérapeutiques. Les membranes qui se sont avérées efficaces pour l'administration bactérienne comprennent l' acétate de cellulose et des variantes d' alginate . Des utilisations supplémentaires résultant de l'encapsulation de cellules bactériennes comprennent la protection contre la provocation par M. Tuberculosis et la régulation à la hausse des cellules sécrétant des Ig par le système immunitaire. La technologie est limitée par le risque d'infections systémiques, les activités métaboliques indésirables et le risque de transfert de gènes. Cependant, le plus grand défi reste la livraison de suffisamment de bactéries viables au site d'intérêt.
Cellules sanguines artificielles comme transporteurs d'oxygène
Les transporteurs d'oxygène de taille nanométrique sont utilisés comme un type de substituts de globules rouges , bien qu'ils manquent d'autres composants des globules rouges. Ils sont composés d'un polymersome synthétique ou d'une membrane artificielle entourant de l' hémoglobine purifiée animale, humaine ou recombinante . Dans l'ensemble, l'administration d'hémoglobine continue d'être un défi car elle est hautement toxique lorsqu'elle est administrée sans aucune modification. Dans certains essais cliniques, des effets vasopresseurs ont été observés.
Globules rouges artificiels
L'intérêt de la recherche pour l'utilisation de cellules artificielles pour le sang est né après la peur du sida dans les années 1980. En plus de contourner le potentiel de transmission de maladies, les globules rouges artificiels sont souhaités car ils éliminent les inconvénients associés aux transfusions sanguines allogéniques tels que le typage sanguin, les réactions immunitaires et sa courte durée de conservation de 42 jours. Un substitut d' hémoglobine peut être conservé à température ambiante et non au réfrigérateur pendant plus d'un an. Des tentatives ont été faites pour développer un globule rouge fonctionnel complet qui comprend non seulement un transporteur d'oxygène carbonique mais également les enzymes associées à la cellule. La première tentative a été faite en 1957 en remplaçant la membrane des globules rouges par une membrane polymère ultrafine qui a été suivie d'une encapsulation à travers une membrane lipidique et plus récemment une membrane polymère biodégradable. Une membrane biologique de globules rouges comprenant des lipides et des protéines associées peut également être utilisée pour encapsuler des nanoparticules et augmenter le temps de résidence in vivo en contournant l' absorption des macrophages et la clairance systémique.
Leuco-polymères artificiels
Un leuco-polymèresome est un polymersome conçu pour avoir les propriétés adhésives d'un leucocyte . Les polymères sont des vésicules composées d'une feuille bicouche pouvant encapsuler de nombreuses molécules actives telles que des médicaments ou des enzymes . En ajoutant les propriétés adhésives d'un leucocyte à leurs membranes, ils peuvent ralentir ou rouler le long des parois épithéliales dans le système circulatoire à écoulement rapide .
Types non conventionnels de cellules artificielles
Cellule artificielle électronique
Le concept de cellule électronique artificielle a été développé dans une série de 3 projets européens coordonnés par John McCaskill de 2004 à 2015.
La Commission européenne a parrainé le développement du programme Programmable Artificial Cell Evolution (PACE) de 2004 à 2008 dont l'objectif était de jeter les bases de la création « d'entités autonomes microscopiques auto-organisées, auto-réplicables et évolutives construites à partir de simples éléments organiques et substances inorganiques qui peuvent être génétiquement programmées pour remplir des fonctions spécifiques" pour l'intégration éventuelle dans les systèmes d'information. Le projet PACE a développé la première machine Omega, un système de survie microfluidique pour cellules artificielles qui pourrait compléter les fonctionnalités chimiquement manquantes (comme proposé à l'origine par Norman Packard, Steen Rasmussen, Mark Beadau et John McCaskill). L'objectif ultime était d'obtenir une cellule hybride évolutive dans un environnement programmable à micro-échelle complexe. Les fonctions de la machine Omega pourraient ensuite être supprimées progressivement, posant une série de défis d'évolution solubles à la chimie des cellules artificielles. Le projet a réalisé une intégration chimique jusqu'au niveau des paires des trois fonctions centrales des cellules artificielles (un sous-système génétique, un système de confinement et un système métabolique) et a généré de nouveaux environnements microfluidiques programmables résolus spatialement pour l'intégration du confinement et de l'amplification génétique. Le projet a conduit à la création du centre européen des technologies vivantes.
À la suite de ces recherches, en 2007, John McCaskill a proposé de se concentrer sur une cellule artificielle complétée électroniquement, appelée Electronic Chemical Cell. L'idée clé était d'utiliser un réseau massivement parallèle d'électrodes couplées à des circuits électroniques dédiés localement, dans un film mince bidimensionnel, pour compléter la fonctionnalité cellulaire chimique émergente. Les informations électroniques locales définissant les circuits de commutation et de détection des électrodes pourraient servir de génome électronique, complétant les informations moléculaires séquentielles dans les protocoles émergents. Une proposition de recherche a été couronnée de succès avec la Commission européenne et une équipe internationale de scientifiques chevauchant partiellement le consortium PACE a commencé les travaux 2008-2012 sur le projet Electronic Chemical Cells. Le projet a notamment démontré que le transport local contrôlé électroniquement de séquences spécifiques pouvait être utilisé comme système de contrôle spatial artificiel pour la prolifération génétique de futures cellules artificielles, et que les processus essentiels du métabolisme pouvaient être assurés par des réseaux d'électrodes enrobés de manière appropriée.
La limitation majeure de cette approche, outre les difficultés initiales de maîtrise de l'électrochimie et de l'électrocinétique microscopiques, est que le système électronique est interconnecté en tant que pièce rigide non autonome de matériel macroscopique. En 2011, McCaskill a proposé d'inverser la géométrie de l'électronique et de la chimie : au lieu de placer des produits chimiques dans un milieu électronique actif, de placer de l'électronique autonome microscopique dans un milieu chimique. Il a organisé un projet pour s'attaquer à une troisième génération de cellules artificielles électroniques à l'échelle 100 µm qui pourraient s'auto-assembler à partir de deux demi-cellules « étiquettes » pour enfermer un espace chimique interne et fonctionner à l'aide d'une électronique active alimentée par le milieu. elles sont immergées. De telles cellules peuvent copier à la fois leur contenu électronique et chimique et seront capables d'évoluer dans les contraintes fournies par leurs blocs de construction microscopiques pré-synthétisés spéciaux. En septembre 2012, les travaux ont commencé sur ce projet.
Jeewanu
Les protocellules de Jeewanu sont des particules chimiques synthétiques qui possèdent une structure semblable à celle des cellules et semblent avoir des propriétés vivantes fonctionnelles. Synthétisé pour la première fois en 1963 à partir de minéraux simples et de substances organiques basiques alors qu'il était exposé à la lumière du soleil , il aurait encore des capacités métaboliques, la présence d' une membrane semi - perméable , d' acides aminés , de phospholipides , de glucides et de molécules de type ARN. Cependant, la nature et les propriétés du Jeewanu restent à clarifier.
Voir également
- Protocellule
- La biologie de synthèse
- Vie artificielle
- Distribution ciblée de médicaments
- Respirocyte
- Chemoton
- Jeewanu
- Construire une cellule
Les références
Liens externes
- Cellules artificielles, substituts sanguins et biotechnologie Journal of Artificial Cells Substituts sanguins et biotechnologie