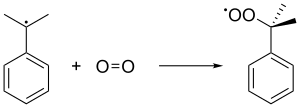Processus de cumène - Cumene process
Le processus de cumène ( de processus cumène-phénol , procédé Hock ) est un procédé industriel de synthèse de phénol et d' acétone à partir du benzène et du propylene . Le terme provient du cumène (isopropyl benzène), le matériau intermédiaire au cours du processus. Il a été inventé par R. Ūdris et P. Sergeyev en 1942 (URSS)., et indépendamment par Heinrich Hock en 1944
Ce procédé convertit deux matières premières relativement bon marché, le benzène et le propylène , en deux matières plus précieuses, le phénol et l' acétone . Les autres réactifs nécessaires sont l' oxygène de l'air et de petites quantités d'un initiateur radicalaire . La majeure partie de la production mondiale de phénol et d' acétone repose désormais sur cette méthode. En 2003, près de 7 millions de tonnes de phénol ont été produites par le procédé au cumène. Pour que ce procédé soit économique, il doit également y avoir une demande pour le sous-produit acétone ainsi que le phénol .
Étapes du processus
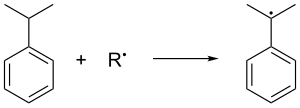
Le cumène est formé dans l' alkylation Friedel-Crafts en phase gazeuse du benzène par le propène. Le benzène et le propène sont comprimés ensemble à une pression de 30 atmosphères standard à 250 °C en présence d'un acide de Lewis catalytique . L'acide phosphorique est souvent préféré aux halogénures d' aluminium . Le cumène est oxydé dans l'air, ce qui élimine l' hydrogène benzylique tertiaire du cumène et forme ainsi un radical cumène :
Le radical cumène se lie ensuite à une molécule d'oxygène pour donner le radical peroxyde de cumène , qui forme à son tour de l' hydroperoxyde de cumène (C 6 H 5 C (CH 3 ) 2 O 2 H) en extrayant un hydrogène benzylique d'une autre molécule de cumène. Ce dernier cumène se transforme en radical cumène et se réintroduit dans les formations de chaînes ultérieures d'hydroperoxydes de cumène. Une pression de 5 atm est utilisée pour garantir que le peroxyde instable est maintenu à l'état liquide.
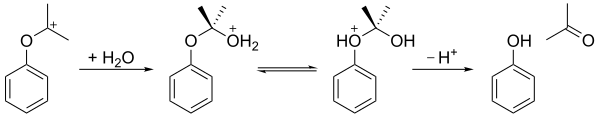
L'hydroperoxyde de cumène est ensuite hydrolysé en milieu acide (le réarrangement de Hock ) pour donner du phénol et de l' acétone . Dans la première étape, l'atome d'oxygène hydroperoxy terminal est protoné. Ceci est suivi d'une étape dans laquelle le groupe phényle migre du carbone benzylique vers l'oxygène adjacent et une molécule d'eau est perdue, produisant un carbocation tertiaire stabilisé par résonance . Le mécanisme concerté de cette étape est similaire aux mécanismes de l' oxydation de Baeyer-Villiger ainsi qu'à l'étape d'oxydation de l' hydroboration-oxydation . En 2009, une argile bentonite acidifiée s'est avérée être un catalyseur plus économique que l'acide sulfurique comme milieu acide.
Comme indiqué ci-dessous, le carbocation résultant est ensuite attaqué par l'eau, un proton est ensuite transféré de l'oxygène hydroxylé à l'oxygène éther, et enfin l'ion se désagrège en phénol et acétone.
Réactions et modifications associées
Alternatives à la coproduction d'acétone
Le cyclohexylbenzène peut remplacer l'isopropylbenzène. Via le réarrangement de Hock, l'hydroperoxyde de cyclohexylbenzène se clive pour donner le phénol et la cyclohexanone . La cyclohexanone est un précurseur important de certains nylons .
A partir de l'alkylation du benzène avec un mélange de 1 et 2-butènes , le procédé au cumène produit du phénol et des butanones .
Alternatives à la production de phénol
- L'hydroquinone est préparée par dialkylation du benzène avec du propène pour donner du 1,4-diisopropylbenzène . Ce composé réagit avec l'air pour donner le bis(hydroperoxyde). Analogue au comportement de l' hydroperoxyde de cumène , il se réarrange en acide pour donner de l' acétone et de l'hydroquinone. L'oxydation de l'hydroquinone donne la 1,4-benzoquinone :
- C 6 H 4 (CHMe 2 ) 2 + 2,5 O 2 → C 6 H 4 O 2 + 2 OCMe 2 + H 2 O
- Le résorcinol est préparé de manière analogue en convertissant le 1,3-diisopropylbenzène en bis(hydroperoxyde), qui se fragmente en résorcinol et en acétone.
- Le 2-naphtol peut également être produit par un procédé analogue au procédé au cumène.
- Le 3-chlorophénol , qui ne résulte pas de la chloration du phénol, peut être produit par le procédé au cumène en commençant par l'alkylation du chlorobenzène avec le propylène.
- Les crésols sont produits à partir d'isopropyltoluène.
Traitement de l'acétone
L'acétone brute est hydrogénée en phase liquide sur du nickel de Raney ou un mélange de cuivre et d'oxyde de chrome pour donner l'alcool isopropylique . Ce procédé est utile, lorsqu'il est couplé à une production excessive d'acétone. [1]
Mitsui & Co. a développé des étapes supplémentaires pour hydrogéner l' acétone et déshydrogéner le produit isopropanol en propène, qui est recyclé comme réactif de départ.
Voir également
- bisphénol A
- Processus de Dow
- L'alkylation de Friedel Crafts
- Oxydation de Baeyer-Villiger
- Procédé Raschig-Hooker (produit également du phénol)