Chromatographie en phase gazeuse – spectrométrie de masse - Gas chromatography–mass spectrometry
La chromatographie en phase gazeuse-spectrométrie de masse ( GC-MS ) est une méthode analytique qui combine les caractéristiques de la chromatographie en phase gazeuse et de la spectrométrie de masse pour identifier différentes substances dans un échantillon d'essai. Les applications de la GC-MS comprennent la détection de drogues , les enquêtes sur les incendies , l'analyse environnementale, les enquêtes sur les explosifs et l'identification d'échantillons inconnus, y compris ceux d'échantillons de matériaux obtenus de la planète Mars lors de missions de sonde dès les années 1970. Le GC-MS peut également être utilisé en sécurité aéroportuaire pour détecter des substances dans les bagages ou sur les êtres humains. De plus, il peut identifier les oligo-élémentsdans des matériaux que l'on pensait auparavant s'être désintégrés au-delà de l'identification. Comme la chromatographie liquide-spectrométrie de masse , elle permet l'analyse et la détection même de petites quantités d'une substance.
La GC-MS a été considérée comme un « étalon-or » pour l' identification médico-légale des substances car elle est utilisée pour effectuer un test 100 % spécifique , qui identifie positivement la présence d'une substance particulière. Un test non spécifique indique simplement que l'une quelconque de plusieurs dans une catégorie de substances est présente. Bien qu'un test non spécifique puisse suggérer statistiquement l'identité de la substance, cela pourrait conduire à une identification faussement positive . Cependant, les températures élevées (300°C) utilisées dans le port d'injection GC-MS (et le four) peuvent entraîner une dégradation thermique des molécules injectées, entraînant ainsi la mesure des produits de dégradation au lieu de la ou des molécules d'intérêt réelles.
Histoire
Le premier couplage en ligne de la chromatographie en phase gazeuse à un spectromètre de masse a été signalé en 1959. Le développement d' ordinateurs abordables et miniaturisés a contribué à la simplification de l'utilisation de cet instrument, et a permis de grandes améliorations dans le temps qu'il faut pour analyser un échantillon. En 1964, Electronic Associates, Inc. (EAI) , l'un des principaux fournisseurs américains d'ordinateurs analogiques, a commencé le développement d'un spectromètre de masse quadripolaire contrôlé par ordinateur sous la direction de Robert E. Finnigan . En 1966, la division EAI de Finnigan et de son collaborateur Mike Uthe avait vendu plus de 500 analyseurs de gaz résiduels quadripolaires. En 1967, Finnigan quitte EAI pour former la Finnigan Instrument Corporation avec Roger Sant, TZ Chou, Michael Story, Lloyd Friedman et William Fies. Au début de 1968, ils ont livré le premier prototype d'instruments quadripolaires GC/MS à Stanford et Purdue University. Lorsque Finnigan Instrument Corporation a été acquise par Thermo Instrument Systems (plus tard Thermo Fisher Scientific ) en 1990, elle était considérée comme « le premier fabricant mondial de spectromètres de masse ».
Instrumentation
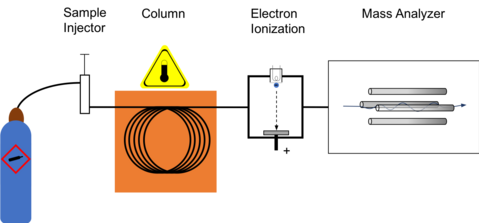
Le GC-MS est composé de deux blocs de construction principaux : le chromatographe en phase gazeuse et le spectromètre de masse . Le chromatographe en phase gazeuse utilise une colonne capillaire dont les propriétés concernant la séparation des molécules dépendent des dimensions de la colonne (longueur, diamètre, épaisseur du film) ainsi que des propriétés de la phase (par exemple 5% de phényl polysiloxane). La différence des propriétés chimiques entre les différentes molécules d'un mélange et leur affinité relative pour la phase stationnaire de la colonne favoriseront la séparation des molécules lorsque l'échantillon parcourt la longueur de la colonne. Les molécules sont retenues par la colonne puis éluées (se détachent) de la colonne à différents moments (appelé temps de rétention), ce qui permet au spectromètre de masse en aval de capturer, ioniser, accélérer, dévier et détecter les molécules ionisées séparément. Le spectromètre de masse le fait en brisant chaque molécule en fragments ionisés et en détectant ces fragments à l'aide de leur rapport masse/charge.
Ces deux composants, utilisés ensemble, permettent un degré d'identification de la substance beaucoup plus fin que chaque unité utilisée séparément. Il n'est pas possible de faire une identification précise d'une molécule particulière par chromatographie en phase gazeuse ou spectrométrie de masse seule. Le processus de spectrométrie de masse nécessite normalement un échantillon très pur tandis que la chromatographie en phase gazeuse utilisant un détecteur traditionnel (par exemple, un détecteur à ionisation de flamme ) ne peut pas différencier plusieurs molécules qui prennent le même temps pour traverser la colonne ( c'est -à- dire qui ont le même temps de rétention) , ce qui entraîne la co-élution de deux molécules ou plus. Parfois, deux molécules différentes peuvent également avoir un motif similaire de fragments ionisés dans un spectromètre de masse (spectre de masse). La combinaison des deux processus réduit le risque d'erreur, car il est extrêmement improbable que deux molécules différentes se comportent de la même manière dans un chromatographe en phase gazeuse et un spectromètre de masse. Par conséquent, lorsqu'un spectre de masse d'identification apparaît à un temps de rétention caractéristique dans une analyse GC-MS, cela augmente généralement la certitude que l'analyte d'intérêt se trouve dans l'échantillon.
Purge et piège GC-MS
Pour l'analyse des composés volatils, un système de concentrateur à purge et piège (P&T) peut être utilisé pour introduire les échantillons. Les analytes cibles sont extraits en mélangeant l'échantillon avec de l'eau et en purgeant avec un gaz inerte (par exemple de l' azote gazeux ) dans une chambre hermétique, c'est ce qu'on appelle la purge ou le barbotage . Les composés volatils se déplacent dans l'espace libre au-dessus de l'eau et sont entraînés le long d'un gradient de pression (causé par l'introduction du gaz de purge) hors de la chambre. Les composés volatils sont attirés le long d'une ligne chauffée sur un « piège ». Le piège est une colonne de matériau adsorbant à température ambiante qui retient les composés en les remettant en phase liquide. Le piège est ensuite chauffé et les composés de l'échantillon sont introduits dans la colonne GC-MS via une interface volatils, qui est un système d'admission divisé. P&T GC-MS est particulièrement adapté aux composés organiques volatils (COV) et aux composés BTEX (composés aromatiques associés au pétrole).
Une alternative plus rapide est le système de "purge-boucle fermée". Dans ce système, le gaz inerte est barboté dans l'eau jusqu'à ce que les concentrations de composés organiques dans la phase vapeur soient en équilibre avec les concentrations dans la phase aqueuse. La phase gazeuse est ensuite analysée directement.
Types de détecteurs de spectromètre de masse
Le type le plus courant de spectromètre de masse (MS) associé à un chromatographe en phase gazeuse (GC) est le spectromètre de masse quadripolaire, parfois désigné par le nom commercial Hewlett-Packard (maintenant Agilent ) "Mass Selective Detector" (MSD). Un autre détecteur relativement courant est le spectromètre de masse à piège à ions. De plus, on peut trouver un spectromètre de masse à secteur magnétique, mais ces instruments particuliers sont coûteux et encombrants et ne se trouvent généralement pas dans les laboratoires de service à haut débit. D'autres détecteurs peuvent être rencontrés comme le temps de vol (TOF), les quadripôles tandem (MS-MS) (voir ci-dessous), ou dans le cas d'un piège à ions MS n où n désigne le nombre d'étages de spectrométrie de masse.
GC-tandem MS
Lorsqu'une deuxième phase de fragmentation de masse est ajoutée, par exemple à l'aide d'un deuxième quadripôle dans un instrument quadripôle, on parle de MS tandem (MS/MS). MS/MS peut parfois être utilisé pour quantifier de faibles niveaux de composés cibles en présence d'un fond de matrice d'échantillon élevé.
Le premier quadripôle (Q1) est connecté à une cellule de collision (Q2) et à un autre quadripôle (Q3). Les deux quadripôles peuvent être utilisés en mode balayage ou statique, selon le type d'analyse MS/MS effectuée. Les types d'analyse comprennent l'analyse des ions produits, l'analyse des ions précurseurs, la surveillance des réactions sélectionnées (SRM) (parfois appelée surveillance des réactions multiples (MRM)) et l'analyse des pertes neutres. Par exemple : Lorsque Q1 est en mode statique (en regardant une seule masse comme dans SIM), et Q3 est en mode balayage, on obtient un spectre dit d'ions produits (appelé aussi "spectre fille"). A partir de ce spectre, on peut sélectionner un ion produit important qui peut être l'ion produit pour l'ion précurseur choisi. La paire est appelée une « transition » et constitue la base du SRM. SRM est hautement spécifique et élimine pratiquement le fond de la matrice.
Ionisation
Une fois que les molécules ont parcouru la longueur de la colonne, traversé la ligne de transfert et entré dans le spectromètre de masse, elles sont ionisées par diverses méthodes, une seule méthode étant généralement utilisée à un moment donné. Une fois l'échantillon fragmenté, il sera ensuite détecté, généralement par un multiplicateur d'électrons , qui transforme essentiellement le fragment de masse ionisé en un signal électrique qui est ensuite détecté.
La technique d'ionisation choisie est indépendante de l'utilisation du full scan ou de la SIM.
Ionisation électronique
La forme d'ionisation de loin la plus courante et peut-être standard est l'ionisation électronique (EI). Les molécules entrent dans le MS (la source est un quadripôle ou le piège à ions lui-même dans un piège à ions MS) où elles sont bombardées d'électrons libres émis par un filament, un peu comme le filament que l'on trouverait dans une ampoule standard. Les électrons bombardent les molécules, provoquant la fragmentation de la molécule de manière caractéristique et reproductible. Cette technique "d'ionisation dure" entraîne la création de davantage de fragments de faible rapport masse/charge (m/z) et de quelques molécules, voire aucune, approchant l'unité de masse moléculaire. L'ionisation dure est considérée par les spectromètres de masse comme l'emploi d'un bombardement électronique moléculaire, alors que "l'ionisation douce" est une charge par collision moléculaire avec un gaz introduit. Le modèle de fragmentation moléculaire dépend de l'énergie électronique appliquée au système, typiquement 70 eV (électronvolts). L'utilisation de 70 eV facilite la comparaison des spectres générés avec les spectres de la bibliothèque à l'aide d'un logiciel fourni par le fabricant ou d'un logiciel développé par le National Institute of Standards (NIST-USA). Les recherches dans les bibliothèques spectrales utilisent des algorithmes d'appariement tels que l'appariement basé sur les probabilités et l'appariement de produits scalaires qui sont utilisés avec des méthodes d'analyse écrites par de nombreuses agences de normalisation de méthodes. Les sources de bibliothèques incluent le NIST, Wiley, l'AAFS et les fabricants d'instruments.
Ionisation électronique froide
Le processus "d'ionisation dure" de l'ionisation des électrons peut être adouci par le refroidissement des molécules avant leur ionisation, d'où des spectres de masse plus riches en informations. Dans cette méthode appelée ionisation par électrons froids (EI froid), les molécules sortent de la colonne GC, mélangées avec de l'hélium ajouté du gaz d'appoint et se dilatent dans le vide à travers une buse supersonique spécialement conçue, formant un faisceau moléculaire supersonique (SMB). Les collisions avec le gaz d'appoint au niveau du jet supersonique en expansion réduisent l'énergie vibratoire (et rotationnelle) interne des molécules d'analyte, réduisant ainsi le degré de fragmentation causé par les électrons pendant le processus d'ionisation. Les spectres de masse Cold-EI sont caractérisés par un ion moléculaire abondant tandis que le motif de fragmentation habituel est conservé, rendant ainsi les spectres de masse Cold-EI compatibles avec les techniques d'identification de recherche en bibliothèque. Les ions moléculaires améliorés augmentent les probabilités d'identification des composés connus et inconnus, amplifient les effets spectraux de masse des isomères et permettent l'utilisation de l'analyse de l'abondance des isotopes pour l'élucidation des formules élémentaires.
Ionisation chimique
Dans l'ionisation chimique (CI), un gaz réactif, généralement du méthane ou de l' ammoniac, est introduit dans le spectromètre de masse. Selon la technique (CI positif ou CI négatif) choisie, ce gaz réactif va interagir avec les électrons et l'analyte et provoquer une ionisation « douce » de la molécule d'intérêt. Une ionisation plus douce fragmente la molécule à un degré inférieur à l'ionisation dure de l'IE. L'un des principaux avantages de l'utilisation de l'ionisation chimique est qu'un fragment de masse correspondant étroitement au poids moléculaire de l'analyte d'intérêt est produit.
Dans l'ionisation chimique positive (PCI), le gaz réactif interagit avec la molécule cible, le plus souvent avec un échange de protons. Cela produit l'espèce en quantités relativement élevées.
Dans l'ionisation chimique négative (NCI), le gaz réactif diminue l'impact des électrons libres sur l'analyte cible. Cette énergie réduite laisse généralement le fragment en grande quantité.
Une analyse
Un spectromètre de masse est généralement utilisé de l'une des deux manières suivantes : balayage complet ou surveillance sélective des ions (SIM). L'instrument GC-MS typique est capable d'exécuter les deux fonctions individuellement ou simultanément, selon la configuration de l'instrument particulier.
L'objectif principal de l'analyse instrumentale est de quantifier une quantité de substance. Ceci est fait en comparant les concentrations relatives parmi les masses atomiques dans le spectre généré. Deux types d'analyses sont possibles, comparative et originale. L'analyse comparative compare essentiellement le spectre donné à une bibliothèque de spectres pour voir si ses caractéristiques sont présentes pour certains échantillons de la bibliothèque. Ceci est mieux réalisé par un ordinateur car il existe une myriade de distorsions visuelles qui peuvent se produire en raison des variations d'échelle. Les ordinateurs peuvent également corréler simultanément plus de données (telles que les temps de rétention identifiés par GC), pour relier plus précisément certaines données. Il a été démontré que l'apprentissage en profondeur conduisait à des résultats prometteurs dans l'identification des COV à partir de données brutes de GC-MS
Une autre méthode d'analyse mesure les pics les uns par rapport aux autres. Dans cette méthode, le pic le plus haut se voit attribuer 100 % de la valeur et les autres pics se voient attribuer des valeurs proportionnelles. Toutes les valeurs supérieures à 3 % sont attribuées. La masse totale du composé inconnu est normalement indiquée par le pic parent. La valeur de ce pic parent peut être utilisée pour s'adapter à une formule chimique contenant les divers éléments que l'on pense être dans le composé. Le modèle isotopique dans le spectre, qui est unique pour les éléments qui ont de nombreux isotopes naturels, peut également être utilisé pour identifier les divers éléments présents. Une fois qu'une formule chimique a été adaptée au spectre, la structure moléculaire et la liaison peuvent être identifiées et doivent être cohérentes avec les caractéristiques enregistrées par GC-MS. Typiquement, cette identification se fait automatiquement par des programmes livrés avec l'instrument, à partir d'une liste des éléments qui pourraient être présents dans l'échantillon.
Une analyse du « spectre complet » considère tous les « pics » d'un spectre. À l'inverse, la surveillance sélective des ions (SIM) ne surveille que les ions sélectionnés associés à une substance spécifique. Ceci est fait en supposant qu'à un temps de rétention donné, un ensemble d' ions est caractéristique d'un certain composé. Il s'agit d'une analyse rapide et efficace, en particulier si l'analyste dispose d'informations antérieures sur un échantillon ou ne recherche que quelques substances spécifiques. Lorsque la quantité d'informations collectées sur les ions dans un pic de chromatographie en phase gazeuse donné diminue, la sensibilité de l'analyse augmente. Ainsi, l'analyse SIM permet de détecter et de mesurer une plus petite quantité d'un composé, mais le degré de certitude quant à l'identité de ce composé est réduit.
Analyse complète MS
Lors de la collecte de données en mode de balayage complet, une plage cible de fragments de masse est déterminée et intégrée à la méthode de l'instrument. Un exemple d'une large gamme typique de fragments de masse à surveiller serait m/z 50 à m/z 400. La détermination de la gamme à utiliser est largement dictée par ce que l'on prévoit être dans l'échantillon tout en étant conscient du solvant et des autres interférences possibles. Un MS ne doit pas être configuré pour rechercher des fragments de masse trop faibles ou bien on peut détecter de l'air (trouvé comme m/z 28 en raison de l'azote), du dioxyde de carbone ( m/z 44) ou d'autres interférences possibles. De plus, si l'on doit utiliser une large plage de balayage, la sensibilité de l'instrument est diminuée en raison du nombre inférieur de balayages par seconde, car chaque balayage devra détecter une large gamme de fragments de masse.
L'analyse complète est utile pour déterminer les composés inconnus dans un échantillon. Il fournit plus d'informations que SIM lorsqu'il s'agit de confirmer ou de résoudre des composés dans un échantillon. Pendant le développement de la méthode instrumentale, il peut être courant d'analyser d'abord les solutions de test en mode balayage complet pour déterminer le temps de rétention et l'empreinte du fragment de masse avant de passer à une méthode instrumentale SIM.
Surveillance sélective des ions
Dans la surveillance sélective des ions (SIM), certains fragments d'ions sont entrés dans la méthode de l'instrument et seuls ces fragments de masse sont détectés par le spectromètre de masse. Les avantages de SIM sont que la limite de détection est plus basse puisque l'instrument ne regarde qu'un petit nombre de fragments (par exemple trois fragments) pendant chaque balayage. Plus d'analyses peuvent avoir lieu chaque seconde. Étant donné que seuls quelques fragments de masse d'intérêt sont surveillés, les interférences matricielles sont généralement plus faibles. Pour confirmer en outre la probabilité d'un résultat potentiellement positif, il est relativement important de s'assurer que les rapports ioniques des différents fragments de masse sont comparables à une norme de référence connue.
Applications
Surveillance et nettoyage de l'environnement
La GC-MS devient l'outil de choix pour le suivi des polluants organiques dans l'environnement. Le coût de l'équipement GC-MS a considérablement diminué et la fiabilité a augmenté en même temps, ce qui a contribué à son adoption accrue dans les études environnementales .
Médecine légale
La GC-MS peut analyser les particules d'un corps humain afin d'aider à relier un criminel à un crime . L'analyse des débris d' incendie à l' aide de la GC-MS est bien établie, et il existe même une norme établie par l'American Society for Testing and Materials (ASTM) pour l'analyse des débris d'incendie. Le GCMS/MS est particulièrement utile ici car les échantillons contiennent souvent des matrices très complexes et les résultats, utilisés au tribunal, doivent être très précis.
Forces de l'ordre
La GC-MS est de plus en plus utilisée pour la détection de stupéfiants illégaux et pourrait éventuellement supplanter les chiens renifleurs de drogue. [1] Une méthode GC-MS simple et sélective pour détecter la consommation de marijuana a été récemment développée par le Robert Koch-Institute en Allemagne. Il s'agit d'identifier un métabolite acide du tétrahyhydrocannabinol (THC), l'ingrédient actif de la marijuana, dans des échantillons d'urine en utilisant la dérivatisation dans la préparation de l'échantillon. La GC-MS est également couramment utilisée en toxicologie médico-légale pour trouver des médicaments et/ou des poisons dans des échantillons biologiques de suspects, de victimes ou de personnes décédées. Dans le criblage de médicaments, les méthodes GC-MS utilisent fréquemment l'extraction liquide-liquide dans le cadre de la préparation des échantillons, dans laquelle les composés cibles sont extraits du plasma sanguin.
Analyse antidopage sportive
La GC-MS est le principal outil utilisé dans les laboratoires antidopage du sport pour tester les échantillons d'urine des athlètes à la recherche de drogues interdites améliorant la performance, par exemple les stéroïdes anabolisants .
Sécurité
Un développement après le 11 septembre, les systèmes de détection d'explosifs sont devenus une partie de tous les aéroports américains . Ces systèmes fonctionnent sur une multitude de technologies, dont beaucoup sont basées sur la GC-MS. Il n'y a que trois fabricants certifiés par la FAA pour fournir ces systèmes, dont Thermo Detection (anciennement Thermedics), qui produit l' EGIS , une gamme de détecteurs d'explosifs basée sur la GC-MS. Les deux autres fabricants sont Barringer Technologies, qui appartient maintenant à Smith's Detection Systems, et Ion Track Instruments, qui fait partie de General Electric Infrastructure Security Systems.
Détection d'agents de guerre chimique
Dans le cadre des efforts déployés après le 11 septembre pour accroître les capacités en matière de sécurité intérieure et de préparation à la santé publique, les unités GC-MS traditionnelles avec spectromètres de masse quadripolaires à transmission, ainsi que celles avec piège à ions cylindrique (CIT-MS) et piège à ions toroïdal (T -ITMS) ont été modifiés pour la portabilité sur le terrain et la détection en temps quasi réel des agents de guerre chimique (CWA) tels que le sarin, le soman et le VX. Ces systèmes GC-MS complexes et volumineux ont été modifiés et configurés avec des chromatographes en phase gazeuse à faible masse thermique (LTM) à chauffage résistif qui réduisent le temps d'analyse à moins de dix pour cent du temps requis dans les systèmes de laboratoire traditionnels. De plus, les systèmes sont plus petits et plus mobiles, y compris des unités montées dans des laboratoires d'analyse mobiles (MAL), tels que ceux utilisés par la United States Marine Corps Chemical and Biological Incident Response Force MAL et d'autres laboratoires similaires, et des systèmes qui sont portés à la main par des équipes de deux personnes ou des individus, beaucoup de bruit pour les détecteurs de masse plus petits. Selon le système, les analytes peuvent être introduits par injection de liquide, désorbés des tubes de sorbant par un procédé de désorption thermique ou par microextraction en phase solide (SPME).
Ingénieur chimiste
La GC-MS est utilisée pour l'analyse de mélanges de composés organiques inconnus. Une utilisation critique de cette technologie est l'utilisation de la GC-MS pour déterminer la composition des bio-huiles traitées à partir de la biomasse brute. La GC-MS est également utilisée dans l'identification de composants en phase continue dans un matériau intelligent, le fluide magnétorhéologique (MR) .
Analyse des aliments, des boissons et des parfums
Les aliments et les boissons contiennent de nombreux composés aromatiques , certains naturellement présents dans les matières premières et d'autres se formant lors de la transformation. La GC-MS est largement utilisée pour l'analyse de ces composés, notamment les esters , les acides gras , les alcools , les aldéhydes , les terpènes, etc. Elle est également utilisée pour détecter et mesurer les contaminants provenant de la détérioration ou de l' altération qui peuvent être nocifs et qui sont souvent contrôlés par agences, par exemple les pesticides .
Astrochimie
Plusieurs GC-MS ont quitté la terre. Deux ont été amenés sur Mars par le programme Viking . Venera 11 et 12 et Pioneer Venus ont analysé l'atmosphère de Vénus avec GC-MS. La sonde Huygens de l' Cassini-Huygens mission a atterri un GC-MS sur Saturne la plus grande lune », Titan . L' instrument d'analyse d'échantillons sur Mars (SAM) du rover MSL Curiosity contient à la fois un chromatographe en phase gazeuse et un spectromètre de masse quadripolaire qui peuvent être utilisés en tandem comme GC-MS. Le matériel de la comète 67P/Churyumov-Gerasimenko a été analysé par la mission Rosetta avec un GC-MS chiral en 2014.
Médicament
Des dizaines de maladies métaboliques congénitales également connues sous le nom d' erreurs innées du métabolisme (IEM) sont désormais détectables par les tests de dépistage néonatal , en particulier les tests utilisant la chromatographie en phase gazeuse-spectrométrie de masse. La GC-MS peut déterminer des composés dans l'urine même en concentration mineure. Ces composés ne sont normalement pas présents mais apparaissent chez les individus souffrant de troubles métaboliques. Cela devient de plus en plus un moyen courant de diagnostiquer l'IEM pour un diagnostic plus précoce et l'institution d'un traitement conduisant finalement à un meilleur résultat. Il est désormais possible de tester un nouveau-né pour plus de 100 troubles métaboliques génétiques par un test d'urine à la naissance basé sur la GC-MS.
En combinaison avec le marquage isotopique des composés métaboliques, la GC-MS est utilisée pour déterminer l'activité métabolique . La plupart des applications sont basées sur l'utilisation du 13 C comme marquage et la mesure des rapports 13 C- 12 C avec un spectromètre de masse à rapport isotopique (IRMS) ; un MS avec un détecteur conçu pour mesurer quelques ions sélectionnés et renvoyer des valeurs sous forme de rapports.
Voir également
- Électrophorèse capillaire-spectrométrie de masse
- Spectrométrie de mobilité ionique – spectrométrie de masse
- Chromatographie liquide-spectrométrie de masse
- Spectromètre de masse trochoïdal allongé
- Pyrolyse-chromatographie en phase gazeuse-spectrométrie de masse
Les références
Bibliographie
- Adams RP (2007). Identification des composants des huiles essentielles par chromatographie en phase gazeuse/spectrométrie de masse . Allured Pub Corp. ISBN 978-1-932633-21-4.
- Adlard ER, Handley AJ (2001). Techniques et applications de la chromatographie en phase gazeuse . Londres : Sheffield Academic. ISBN 978-0-8493-0521-4.
- Barry EF, Grob RE (2004). Pratique moderne de la chromatographie en phase gazeuse . New York : Wiley-Interscience. ISBN 978-0-471-22983-4.
- Eiceman GA (2000). "Chromatographie des gaz". Dans Meyers RA (éd.). Encyclopédie de chimie analytique : applications, théorie et instrumentation . Chichester : Wiley. p. 10627. ISBN 0-471-97670-9.
- Giannelli PC, Imwinkelried EJ (1999). "Identification de drogue : Chromatographie en phase gazeuse.". Preuve scientifique . 2 . Charlottesville : Éditions de loi de Lexis. p. 362. ISBN 0-327-04985-5.
- McEwen CN, Kitson FG, Larsen BS (1996). Chromatographie en phase gazeuse et spectrométrie de masse : un guide pratique . Boston : Presse académique. ISBN 978-0-12-483385-2.
- McMaster C, McMaster MC (1998). GC/MS : un guide d'utilisation pratique . New York : Wiley. ISBN 978-0-471-24826-2.
- Message GM (1984). Aspects pratiques de la chromatographie en phase gazeuse/spectrométrie de masse . New York : Wiley. ISBN 978-0-471-06277-6.
- Niessen WM (2001). Pratique actuelle de la chromatographie en phase gazeuse-spectrométrie de masse . New York, NY : Marcel Dekker. ISBN 978-0-8247-0473-5.
- Weber A, Maurer HW, Pfleger K (2007). Données spectrales de masse et GC des médicaments, des poisons, des pesticides, des polluants et de leurs métabolites . Weinheim : Wiley-VCH. ISBN 978-3-527-31538-3.
Liens externes
- Gaz+chromatographie-masse+spectrométrie à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis
- Golm Metabolome Database , une base de données de référence spectrale de masse des métabolites végétaux