Cétène - Ketene
Un cétène est un composé organique de la forme R′R″C=C=O, où R et R' sont deux groupes chimiques monovalents arbitraires (ou deux sites de substitution séparés dans la même molécule). Le nom peut également faire référence au composé spécifique éthénone H
2C=C=O , le cétène le plus simple.
Bien qu'ils soient très utiles, la plupart des cétènes sont instables . Lorsqu'ils sont utilisés comme réactifs dans une procédure chimique, ils sont généralement générés en cas de besoin et consommés dès (ou pendant) qu'ils sont produits.
Histoire
Les Ketenes ont d'abord été étudiés en classe par Hermann Staudinger avant 1905.
Les cétènes ont été systématiquement étudiés par Hermann Staudinger en 1905 sous forme de diphénylcétène (conversion du chlorure de -chlorodiphénylacétyle en zinc). Staudinger s'est inspiré des premiers exemples d'intermédiaires organiques réactifs et de radicaux stables découverts par Moses Gomberg en 1900 (composés à groupe triphénylméthyle).
Propriétés
Les cétènes sont hautement électrophiles au niveau de l'atome de carbone lié à l'hétéroatome, en raison de son caractère sp . Le cétène peut être formé avec différents hétéroatomes liés à l' atome de carbone sp , tels que O , S ou Se , respectivement nommés cétène, thiocétène et sélénocétène .
L'éthénone , le cétène le plus simple, a des longueurs expérimentales différentes pour chacune des doubles liaisons ; la liaison C = O est 1 160 Å et la liaison C = C est 1,314Å. L'angle entre les deux atomes H est de 121,5°, similaire à l'angle théoriquement idéal formé dans les alcènes entre l' atome de carbone sp 2 et les substituants H.
Les cétènes sont instables et ne peuvent pas être stockés. En l'absence de nucléophiles avec lequel réagir, Cétène dimérise pour donner β-lactone , un cyclique ester . Si le cétène est disubstitué, le produit de dimérisation est une cyclobutadione substituée. Pour les cétènes monosubstitués, la dimérisation pourrait donner soit l'ester, soit le produit dicétone.
Synthèse
L'éthénone peut être générée par pyrolyse (craquage thermique) de l' acétone :
- CH 3 −CO−CH 3 → CH 2 =C=O + CH 4
Cette réaction est appelée synthèse de cétène de Schmidlin.
D'autres cétènes peuvent être préparés à partir de chlorures d'acyle par une réaction d'élimination dans laquelle HCl est perdu :
Dans cette réaction, une base, généralement la triéthylamine , élimine le proton acide en alpha du groupe carbonyle , induisant la formation de la double liaison carbone-carbone et la perte d'un ion chlorure :
Les cétènes peuvent également être formés à partir de -diazocétones par réarrangement de Wolff .
Une autre façon de générer des cétènes est la thermolyse flash sous vide (FVT) avec des 2- pyridylamines . Plüg et Wentrup ont développé une méthode en 1997 qui a amélioré les réactions FVT pour produire des cétènes avec un FVT stable qui est insensible à l'humidité, en utilisant des conditions douces (480 °C). Les N-pyridylamines sont préparées via une condensation avec des R- malonates avec du N-amino( pyridène ) et du DCC comme solvant.
Une méthode plus robuste pour préparer des cétènes est la carbonylation de carbènes métalliques et la réaction in situ des cétènes hautement réactifs ainsi produits avec des réactifs appropriés tels que des imines , des amines ou des alcools . Ce procédé est un moyen efficace d' un pot protocole en tandem de la carbonylation de composés α-diazocarbonyles et une variété de N -tosylhydrazones catalysée par Co (II) - porphyrine metalloradicals conduisant à la formation de cétènes, qui réagissent ensuite avec une variété de nucléophiles et des imines pour former des esters , des amides et des ‐lactames . Ce système a une large gamme de substrats et peut être appliqué à diverses combinaisons de précurseurs de carbène , de nucléophiles et d' imines .
Réactions et applications
En raison de leurs doubles liaisons cumulées , les cétènes sont très réactifs.
Formation d'esters d'acide carboxylique
Par réaction avec des alcools , il se forme des esters d'acides carboxyliques :
Formation d'anhydrides carboxyliques
Les cétènes réagissent avec un acide carboxylique pour former des anhydrides d'acide carboxylique :
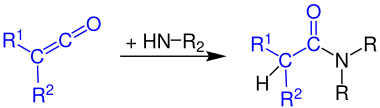
Formation d'amides d'acide carboxylique
Les cétènes réagissent avec l' ammoniac en amides primaires :
La réaction des cétènes avec les amines primaires produit des amides secondaires :
Les cétènes réagissent avec les amines secondaires pour donner des amides tertiaires :
Hydrolyse
Par réaction avec l'eau, des acides carboxyliques sont formés à partir de cétènes
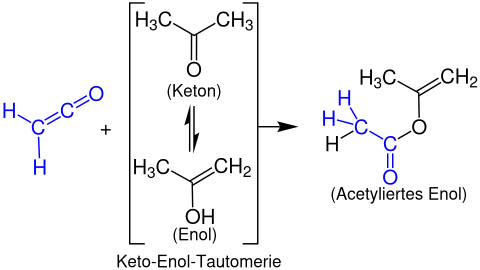
Formation d'esters d'énol
Les esters d' énols sont formés à partir de cétènes avec des composés carbonylés énolisables . L'exemple suivant montre la réaction de l' éthénone avec l' acétone pour former un acétate de propén -2-yle :
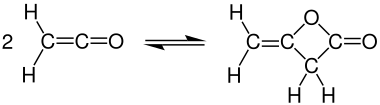
Dimérisation
A température ambiante, le cétène se dimérise rapidement en dicétène , mais le cétène peut être récupéré en chauffant :
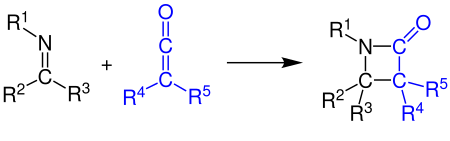
[2+2]-Cycloaddition
Les cétènes peuvent réagir avec les alcènes , les composés carbonylés , les carbodiimides et les imines dans une cycloaddition [2+2] . L'exemple montre la synthèse d'un -lactame par réaction d'un cétène avec une imine (voir synthèse de Staudinger ) :
Applications
Les cétènes sont généralement très réactifs, et participent à diverses cycloadditions . Un processus important est la dimérisation pour donner des propiolactones . Un exemple spécifique est la dimérisation du cétène de l'acide stéarique pour donner des dimères d'alkylcétène , qui sont largement utilisés dans l'industrie papetière. Les AKD réagissent avec les groupes hydroxyle de la cellulose via une réaction d' estérification .
Ils subiront également des réactions de cycloaddition [2+2] avec des alcynes riches en électrons pour former des cyclobuténones , ou des groupes carbonyles pour former des bêta- lactones . Avec les imines, des bêta-lactamines sont formées. C'est la synthèse de Staudinger , une voie facile vers cette classe importante de composés. Avec l' acétone , le cétène réagit pour donner de l'acétate d'isopropényle .
Une variété de composés hydroxyliques peuvent s'ajouter en tant que nucléophiles, formant des produits énol ou ester . À titre d'exemple, une molécule d'eau s'ajoute facilement au cétène pour donner du 1,1-dihydroxyéthène et l'anhydride acétique est produit par la réaction de l'acide acétique avec le cétène. Les réactions entre les diols (HO−R−OH) et les bis-cétènes (O=C=CH−R′−CH=C=O) donnent des polyesters avec une unité de répétition de (−O−R−O−CO−R′− CO).
L'acétoacétate d'éthyle , une matière première importante en synthèse organique, peut être préparé en utilisant un dicétène en réaction avec de l' éthanol . Ils forment directement de l'acétoacétate d'éthyle, et le rendement est élevé lorsqu'il est réalisé dans des conditions contrôlées ; cette méthode est donc utilisée industriellement.
Voir également
Les références
Liens externes
-
 Médias liés à Ketenes sur Wikimedia Commons
Médias liés à Ketenes sur Wikimedia Commons