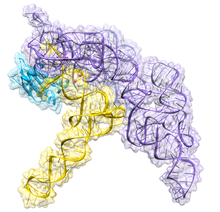
Ribonucléase P - Ribonuclease P
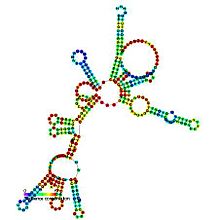
| RNase P bactérienne classe A | |
|---|---|
| |
| Identifiants | |
| symbole | RNaseP_bact_a |
| Rfam | RF00010 |
| Autre informations | |
| Type d' ARN | Gène ; ribozyme |
| Domaines) | Bactéries |
| ALLER | GO:0008033 GO:0004526 GO:0030680 |
| DONC | AINSI : 0000386 |
| Structures de l' APB | PDBe |
| RNase P bactérienne classe B | |
|---|---|

| |
| Identifiants | |
| symbole | RNaseP_bact_b |
| Rfam | RF00011 |
| Autre informations | |
| Type d' ARN | Gène ; ribozyme |
| Domaines) | Bactéries |
| ALLER | GO:0008033 GO:0004526 GO:0030680 |
| DONC | AINSI : 0000386 |
| Structures de l' APB | PDBe |
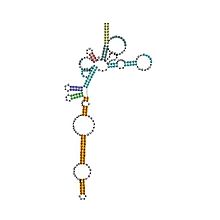
| Archaeal RNase P | |
|---|---|
| |
| Identifiants | |
| symbole | RNaseP_arch |
| Rfam | RF00373 |
| Autre informations | |
| Type d' ARN | Gène ; ribozyme |
| Domaines) | Archées |
| ALLER | GO:0008033 GO:0004526 GO:0030680 |
| DONC | AINSI : 0000386 |
| Structures de l' APB | PDBe |
| Archaeal RNase P classe T | |
|---|---|
| Identifiants | |
| symbole | RNaseP-T |
| Rfam | RF02357 |
| Autre informations | |
| Type d' ARN | Gène ; ribozyme |
| Domaines) | Archées |
| ALLER | GO:0008033 GO:0004526 GO:0030680 |
| DONC | AINSI : 0000386 |
| Structures de l' APB | PDBe |
La ribonucléase P ( EC 3.1.26.5 , RNase P ) est un type de ribonucléase qui clive l' ARN . La RNase P est unique par rapport aux autres RNases en ce qu'elle est un ribozyme – un acide ribonucléique qui agit comme un catalyseur de la même manière qu'une enzyme à base de protéines . Sa fonction est de cliver une séquence supplémentaire, ou précurseur, d'ARN sur les molécules d' ARNt . De plus, la RNase P est l'un des deux ribozymes à renouvellement multiple connus dans la nature (l'autre étant le ribosome ), dont la découverte a valu à Sidney Altman et Thomas Cech le prix Nobel de chimie en 1989 : dans les années 1970, Altman a découvert l'existence d'un précurseur ARNt avec des séquences flanquantes et a été le premier à caractériser la RNase P et son activité dans le traitement de la séquence leader 5' de l'ARNt précurseur. Des découvertes récentes révèlent également que la RNase P a une nouvelle fonction. Il a été démontré que la RNase P nucléaire humaine est nécessaire à la transcription normale et efficace de divers petits ARN non codants , tels que les gènes ARNt, ARNr 5S , ARN SRP et ARNsn U6 , qui sont transcrits par l' ARN polymérase III , l'un des trois principaux gènes nucléaires. ARN polymérases dans les cellules humaines.
Dans les bactéries
La RNase P bactérienne a deux composants : une chaîne d'ARN, appelée ARN M1, et une chaîne polypeptidique, ou protéine, appelée protéine C5. In vivo , les deux composants sont nécessaires au bon fonctionnement du ribozyme, mais in vitro , l'ARN M1 peut agir seul comme catalyseur. Le rôle principal de la protéine C5 est d'améliorer l'affinité de liaison au substrat et le taux catalytique de l'enzyme ARN M1 probablement en augmentant l'affinité des ions métalliques dans le site actif. La structure cristalline d'une holoenzyme RNase P bactérienne avec l'ARNt a été récemment résolue, montrant comment les grands domaines hélicoïdaux empilés de manière coaxiale de l'ARN RNase P s'engagent dans la reconnaissance sélective de la forme de la cible pré-ARNt. Cette structure cristalline confirme les modèles antérieurs de reconnaissance de substrat et de catalyse, identifie l'emplacement du site actif et montre comment le composant protéique augmente la fonctionnalité de la RNase P.
RNase P bactérienne classe A et B
La ribonucléase P (RNase P) est une endoribonucléase ubiquitaire, trouvée dans les archées, les bactéries et les eucariens ainsi que dans les chloroplastes et les mitochondries. Son activité la mieux caractérisée est la génération d'extrémités 5' matures d'ARNt en clivant les éléments de tête 5' des ARNt précurseurs. Les RNase P cellulaires sont des ribonucléoprotéines (RNP). L'ARN de la RNase Ps bactérienne conserve son activité catalytique en l'absence de la sous-unité protéique, c'est-à-dire qu'il s'agit d'un ribozyme. Il n'a pas été démontré que l'ARN RNase P isolé des eucaryotes et des archées conserve sa fonction catalytique, mais il est toujours essentiel pour l'activité catalytique de l'holoenzyme. Bien que les holoenzymes archées et eucaryotes aient une teneur en protéines beaucoup plus importante que les holoenzymes eubactériennes, les noyaux d'ARN des trois lignées sont homologues - les hélices correspondant à P1, P2, P3, P4 et P10/11 sont communes à toutes les RNase P cellulaires. ARN. Pourtant, il existe une variation de séquence considérable, en particulier parmi les ARN eucaryotes.
Aux Archées
Dans les archées , RNase P ribonucléoprotéines consistent en 4-5 sous - unités protéiques qui sont associés à l' ARN. Comme l'ont révélé les expériences de reconstitution in vitro, ces sous-unités protéiques sont individuellement superflues pour le traitement de l'ARNt qui est essentiellement médié par le composant ARN. Les structures des sous-unités protéiques de la RNase P archéenne ont été résolues par cristallographie aux rayons X et RMN , révélant ainsi de nouveaux domaines protéiques et un repliement fondamental pour la fonction.
En utilisant la génomique comparative et des méthodes de calcul améliorées, une forme radicalement minimisée de l'ARN RNase P, surnommée "Type T", a été trouvée dans tous les génomes complets de la famille phylogénétique des Thermoproteaceae, y compris les espèces des genres Pyrobaculum, Caldivirga et Vulcanisaeta. Tous conservent un domaine catalytique conventionnel, mais manquent d'un domaine de spécificité reconnaissable. L'activité de traitement de l'ARNt 5' de l'ARN seul a été confirmée expérimentalement. Les ARN Pyrobaculum et Caldivirga RNase P sont la plus petite forme naturelle jamais découverte pour fonctionner comme des ribozymes agissant en trans. La perte du domaine de spécificité dans ces ARN suggère une spécificité de substrat potentiellement altérée.
Il a été récemment avancé que l'archaebactérie Nanoarchaeum equitans ne possède pas de RNase P. Les études informatiques et expérimentales n'ont pas réussi à trouver de preuves de son existence. Dans cet organisme, le promoteur de l'ARNt est proche du gène de l'ARNt et on pense que la transcription commence à la première base de l'ARNt, supprimant ainsi le besoin de RNase P.
Chez les eucaryotes
Chez les eucaryotes , tels que les humains et les levures , la plupart de la RNase P se compose d'une chaîne d'ARN structurellement similaire à celle trouvée dans les bactéries ainsi que de neuf à dix protéines associées (par opposition à la seule protéine RNase P bactérienne, C5). Cinq de ces sous-unités protéiques présentent une homologie avec leurs homologues archéens. Ces sous - unités protéiques de la RNase P sont partagées avec la RNase MRP , une ribonucléoprotéine catalytique impliquée dans le traitement de l' ARN ribosomique dans le nucléole . La RNase P des eucaryotes n'a été démontrée que récemment comme étant un ribozyme. En conséquence, les nombreuses sous-unités protéiques de la RNase P eucaryale ont une contribution mineure au traitement de l'ARNt en soi, alors qu'elles semblent être essentielles pour la fonction de la RNase P et de la RNase MRP dans d'autres contextes biologiques, tels que la transcription des gènes et le cycle cellulaire . Malgré les origines bactériennes des mitochondries et des chloroplastes, les plastes des animaux supérieurs et des plantes ne semblent pas contenir de RNase P à base d'ARN. Il a été démontré que la RNase P mitochondriale humaine est une protéine et ne contient pas d' ARN . Il a également été démontré que la RNase P du chloroplaste d' épinard fonctionne sans sous-unité d'ARN.
| Sous-unité | Fonction/interaction (dans le traitement de l'ARNt) |
|---|---|
| RPP14 | liaison à l'ARN |
| RPP20 | ATPase, hélicase/Hsp27, SMN, Rpp25 |
| RPP21 | Liaison à l'ARN, activitég/Rpp29 |
| RPP25 | Liaison à l'ARN/Rpp20 |
| RPP29 | Liaison à l'ARNt, activité/Rpp21 |
| RPP30 | Liaison à l'ARN, activité/Pop5 |
| RPP38 | Liaison à l'ARN, activité |
| RPP40 | |
| hPop1 | |
| hPop5 | Liaison à l'ARN, activité/Rpp30 |
| ARN H1 | Activité/Rpp21, Rpp29, Rpp30, Rpp38 |
Thérapies utilisant la RNase P
La RNase P est actuellement étudiée en tant que thérapie potentielle pour des maladies telles que le virus de l' herpès simplex , le cytomégalovirus , la grippe et d'autres infections respiratoires, le VIH-1 et le cancer causé par le gène de fusion BCR-ABL . Les séquences guides externes (SGE) sont formées en complémentarité avec l'ARNm viral ou oncogène et les structures qui imitent la boucle T et la tige acceptrice de l' ARNt . Ces structures permettent à la RNase P de reconnaître l'EGS et de cliver l'ARNm cible. Les thérapies EGS se sont révélées efficaces en culture et chez des souris vivantes.
Les références
Lectures complémentaires
- Frank DN, Pace NR (1998). « Ribonucléase P : unité et diversité dans un ribozyme de traitement d'ARNt » . Revue annuelle de biochimie . 67 : 153-80. doi : 10.1146/annurev.biochem.67.1.153 . PMID 9759486 .
- Brown JW (janvier 1999). "La base de données de la ribonucléase P" . Recherche sur les acides nucléiques . 27 (1) : 314. doi : 10.1093/nar/27.1.314 . PMC 148169 . PMID 9847214 .
Liens externes
- Conférence Nobel de Sidney Altman , prix Nobel de chimie 1989
- Base de données RNase P sur ncsu.edu
- Page pour la RNase P nucléaire chez Rfam
- Page pour Archaeal RNase P chez Rfam
- Page pour Bactérien RNase P classe A chez Rfam
- Page pour Bactérien RNase P classe B chez Rfam
- RNase+P à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis
- CE 3.1.26.5