Amination réductrice - Reductive amination
| Amination réductrice | |
|---|---|
| Type de réaction | Réaction de couplage |
| Identifiants | |
| ID d'ontologie RSC | RXNO: 0000335 |
L'amination réductrice (également connue sous le nom d' alkylation réductrice ) est une forme d' amination qui implique la conversion d'un groupe carbonyle en une amine via une imine intermédiaire . Le groupe carbonyle est le plus souvent une cétone ou un aldéhyde . Il est considéré comme le moyen le plus important de fabriquer des amines, et la majorité des amines fabriquées dans l'industrie pharmaceutique sont fabriquées de cette manière.
Processus de réaction
Dans cette réaction organique , l'amine réagit d'abord avec le groupe carbonyle pour former une espèce hémiaminal , qui perd ensuite une molécule d'eau de manière réversible par alkylimino-désoxo-bisubstitution , pour former l'imine. L'équilibre entre l'aldéhyde / cétone et l'imine peut être déplacé vers la formation d'imine par élimination de l'eau formée par des moyens physiques ou chimiques. Cette imine intermédiaire peut ensuite être isolée et réduite avec un agent réducteur approprié (par exemple, le borohydrure de sodium ). Cette méthode est parfois appelée amination réductrice indirecte.
Dans une approche séparée, la formation et la réduction d'imine peuvent se produire séquentiellement dans un pot. Cette approche, connue sous le nom d'amination réductrice directe, utilise des agents réducteurs qui sont plus réactifs envers les imines protonées qu'envers les précurseurs cétone / aldéhyde. Ces réactifs hydrure doivent également tolérer des conditions modérément acides. Les réactifs typiques qui répondent à ces critères comprennent le cyanoborohydrure de sodium (NaBH 3 CN) et le triacétoxyborohydrure de sodium (NaBH (OCOCH 3 ) 3 ). Cette réaction peut être réalisée en milieu aqueux, ce qui met en doute la nécessité de former l'imine. La réaction se déroule peut-être par réduction des espèces hémiaminales.
Cette réaction est liée à la réaction Eschweiler – Clarke , dans laquelle les amines sont méthylées en amines tertiaires, à la réaction Leuckart – Wallach ou par d'autres méthodes d'alkylation d'amine telles que la réaction de Mannich et la réaction Petasis .
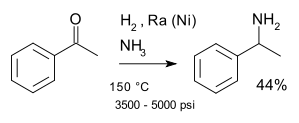
Une réaction nommée classique est la réaction de Mignonac (1921) impliquant la réaction d'une cétone avec de l' ammoniac sur un catalyseur au nickel par exemple dans une synthèse de 1-phényléthylamine à partir d' acétophénone :
De nos jours, l'amination réductrice en un seul pot est réalisée par des catalyseurs acide-métal qui agissent comme un transfert d'hydrure. De nombreuses recherches sur ce type de réaction montrent une efficacité élevée.
Dans l'industrie, les amines tertiaires telles que la triéthylamine et la diisopropyléthylamine sont formées directement à partir de cétones avec un mélange gazeux d'ammoniaque et d' hydrogène et un catalyseur approprié.
Biochimie
Une étape de la biosynthèse de nombreux acides α- aminés est l'amination réductrice d'un α-cétoacide, généralement par une enzyme transaminase . Le processus est catalysé par le phosphate de pyridoxamine , qui est converti en phosphate de pyridoxal après la réaction. L'étape initiale implique la formation d'une imine, mais les équivalents d'hydrure sont fournis par une pyridine réduite pour donner une aldimine, qui s'hydrolyse en amine. La séquence du céto-acide à l'acide aminé peut être résumée comme suit:
- HO 2 CC (O) R → HO 2 CC (= NCH 2 –X) R → HO 2 CCH (N = CH – X) R → HO 2 CCH (NH 2 ) R.
Dans la culture populaire
Dans le drame acclamé par la critique Breaking Bad , le personnage principal Walter White utilise la réaction d'amination réductrice pour produire sa méthamphétamine de haute pureté , en s'appuyant sur la 2-phényl-propanone et la méthylamine . La 2-phényl-propanone (autrement connue sous le nom de phénylacétone ou P2P) est produite à partir d' acide phénylacétique et d'acide acétique en utilisant un four tubulaire et du dioxyde de thorium (ThO 2 ) comme catalyseur.
Voir également
Les références
Liens externes
- Méthodes actuelles d'amination réductrice
- Amination réductrice industrielle chez BASF