Composé Spiro - Spiro compound


Les composés Spiro ont au moins deux cycles moléculaires avec un seul atome commun. Les composés spiro les plus simples sont bicycliques (ayant juste deux cycles), ou ont une partie bicyclique dans le cadre du système cyclique plus large, dans les deux cas avec les deux cycles connectés par l'atome commun unique définissant. L'atome commun reliant les cycles participants distingue les composés spiro des autres bicycliques : des composés à cycle isolés comme le biphényle qui n'ont pas d'atomes de connexion, des composés à cycle fusionné comme la décaline ayant deux cycles liés par deux atomes adjacents, et des composés à cycle ponté comme le norbornane avec deux cycles liés par deux atomes non adjacents.

Les composés spiro peuvent être entièrement carbocycliques (tout en carbone) ou hétérocycliques (ayant un ou plusieurs atomes non carbonés). Un type courant de composé spiro rencontré dans les milieux éducatifs est un hétérocyclique - l' acétal formé par réaction d'un diol avec une cétone cyclique . L'atome commun qui relie les deux (ou parfois trois) anneaux s'appelle l' atome spiro ; dans les composés spiro carbocycliques comme le spiro[5.5]undécane (voir image à droite), le spiro-atome est un carbone quaternaire , et comme l'implique la terminaison -ane, ce sont les types de molécules auxquels le nom de spirane a été appliqué pour la première fois (bien que il est maintenant utilisé en général de tous les composés spiro). De même, un silicium neutre tétravalent ou un atome d' azote quaternaire chargé positivement ( cation ammonium ) peut être le centre spiro dans ces composés, et beaucoup d'entre eux ont été préparés et décrits. Les 2-3 anneaux joints sont le plus souvent de nature différente, bien qu'ils soient parfois identiques [par exemple, spiro[5.5]undécane, juste illustré, et spiropentadiène , à droite]. Bien que les esquisses de structures organiques donnent l'impression que les composés spiro sont plans, ils ne le sont pas ; par exemple, un composé spiro avec une paire d' anneaux de cyclopropène à trois chaînons connectés de manière spiro (image ci-dessous) a reçu le terme impropre d'être une structure de nœud papillon , lorsqu'il n'est pas plat ou plan comme un nœud papillon. Cela peut être dit d'une autre manière, en disant que les plans les mieux adaptés à chaque anneau sont souvent perpendiculaires ou ne sont pas coplanaires les uns par rapport aux autres.
Les composés Spiro sont présents dans le monde naturel, dont certains cas ont été exploités pour fournir des composés outils pour l'étude biomédicale et pour servir d'échafaudages pour la conception d'agents thérapeutiques avec de nouvelles formes. De plus, le motif spiro est présent dans divers types de composés pratiques (tels que les colorants), ainsi que dans une grande variété de conceptions de matériaux oligo- et polymères, pour les formes et propriétés uniques que le centre spiro confère, par exemple, dans la conception de matériaux électroniquement actifs en particulier. Dans les deux cas, la présence du centre spiro, souvent avec quatre groupes distincts attachés, et avec ses aspects uniques de chiralité, ajoute des défis uniques à la synthèse chimique de chaque type de composé.
Composés spiro carbocycliques

Les structures à cycle bicyclique en chimie organique qui ont deux cycles entièrement carbocycliques (tout en carbone) connectés par un seul atome sont présentes à la fois dans les produits naturels , ainsi que dans les cibles ésotériques de la synthèse chimique . Les deux carbocycles peuvent être de nature différente, ou identiques. Dans les cibles communes dérivées de produits naturels, elles sont essentiellement toujours différentes. Dans les cibles ésotériques, telles que les hydrocarbures fortement sollicités comme le spirpentadiène , montrés ici, les anneaux peuvent être identiques. L'atome reliant les deux anneaux s'appelle le spiro-atome ; dans les composés spiro carbocycliques , le spiro-atome est un carbone quaternaire . La structure bicyclique à 11 carbones illustrée ci-dessus, le spiro[5.5]undécane, est également un composé spiro entièrement carbocyclique. Bien que la présentation de cette structure la fasse apparaître entièrement plane, elle ne l'est pas. Les plans les mieux adaptés à chaque anneau de six atomes ci-dessus sont presque perpendiculaires, et les plans les mieux adaptés aux anneaux de composés spiro sont également généralement non coplanaires. Par exemple, la structure du faux nœud papillon spirpentadiène , illustrée ci-dessus, indique clairement que les plans définis par les atomes de chaque anneau, c'est-à-dire le plan le mieux adapté de chaque cyclopropène, sont orthogonaux (perpendiculaires) les uns aux autres.
Composés spiro hétérocycliques

Les composés spiro sont considérés comme hétérocycliques si l'atome spiro ou tout atome de l'un ou l'autre cycle ne sont pas des atomes de carbone. Les cas incluent la présence d'un hétéroatome spiro tel le silicium et l'azote (mais aussi d'autres groupes IVA [14] et d'autres types d'atomes) reliant les cycles observés ou en cours d'étude théorique ; en outre, il existe également de nombreux cas où un ou plusieurs hétéroatomes apparaissent dans un ou plusieurs des cycles qui sont joints à un atome de carbone spiro (par exemple, où 1 oxygène spironolactones et 2 oxygène/2 soufre cétals/thiocétals sont très courants).
Un cas courant est la présence de deux atomes qui ne sont pas du carbone dans l'un des cycles, ces deux cycles étant tous deux attachés à l'atome spiro; en effet, souvent la première exposition d'un chimiste en formation à un composé spiro est à une forme hétérocyclique, le cétal (acétal) formé dans la protection des cétones par les diols et les dithiols . Un exemple de ceci est montré ci-dessus, dans la synthèse de l'acétal 1,4-dioxaspiro[4.5]décane à partir de cyclohexanone et d' éthanediol . Dans ce cas, parce que les quatre atomes attachés à l'atome spiro ne sont pas tous des carbones, l'atome spiro n'est pas un carbone quaternaire. Un autre exemple d' acétal formé à partir d'une cétone cyclique , sauf avec un dithiol , est le composé spiro spirapril , qui a un cycle à cinq chaînons formé à partir de 1,2-éthanedithiol . Encore une fois, alors que les cycles pourraient être identiques, dans le cas hétérocyclique, ils sont, encore une fois, presque toujours non identiques. Encore une fois, les plans les mieux adaptés à chaque anneau ne sont généralement pas coplanaires les uns par rapport aux autres (c'est-à-dire que les anneaux ne sont pas coplanaires, bien qu'ils apparaissent ainsi sur les images).
Composés Polyspiro
Un composé polyspiro est relié par deux ou plusieurs spiroatomes constituant trois anneaux ou plus .
Nomenclature
La nomenclature des composés spiro a été discutée pour la première fois par Adolf von Baeyer en 1900. Le préfixe spiro désigne deux anneaux avec une jonction spiro. La principale méthode de nomenclature systématique est de suivre avec des crochets contenant le nombre d'atomes dans le plus petit cycle puis le nombre d'atomes dans le plus grand cycle, séparés par un point, à chaque fois excluant le spiroatome (l'atome par lequel les deux cycles sont liés) lui-même. La numérotation des positions commence par un atome du plus petit anneau adjacent au spiroatome autour des atomes de cet anneau, puis le spiroatome lui-même, puis autour des atomes du plus grand anneau. Par exemple, le composé A dans l'image est appelé 1-bromo-3-chlorospiro[4.5]decan-7-ol , et le composé B est appelé 1-bromo-3-chlorospiro[3.6]decan-7-ol .
Chiralité
Les spiranes peuvent être chirales , de trois manières distinctes. Premièrement, tout en semblant néanmoins être tordus, ils peuvent encore avoir un centre chiral les rendant analogues à n'importe quel composé chiral simple , et deuxièmement, tout en apparaissant à nouveau tordus, l'emplacement spécifique des substiuents, comme avec les alkylidènecycloalcanes, peut faire un affichage de composé spiro central chiralité (plutôt que chiralité axiale résultant de la torsion) ; troisièmement, les substituants des cycles du composé spiro peuvent être tels que la seule raison pour laquelle ils sont chiraux découle uniquement de la torsion de leurs cycles, par exemple, dans le cas bicyclique le plus simple, où deux cycles structurellement identiques sont attachés via leur atome spiro, résultant en une présentation tordue des deux anneaux. Par conséquent, dans le troisième cas, le manque de planéité décrit ci-dessus donne lieu à ce que l'on appelle la chiralité axiale dans une paire isomérique par ailleurs identique de composés spiro, car ils ne diffèrent que par la "torsion" à droite et à gauche d'anneaux structurellement identiques ( comme on le voit dans les allènes , les biaryles à encombrement stérique et les alkylidènecycloalcanes également). L'attribution de la configuration absolue des composés spiro a été difficile, mais un certain nombre de chaque type a été attribué sans équivoque.
Certains composés spiro présentent une chiralité axiale . Les spiroatomes peuvent être à l'origine de la chiralité même lorsqu'il leur manque les quatre substituants différents requis normalement observés dans la chiralité. Lorsque deux sonneries sont identiques, la priorité est déterminée par une légère modification du système CIP en attribuant une priorité plus élevée à une extension d'anneau et une priorité inférieure à une extension dans l'autre anneau. Lorsque les anneaux sont différents, les règles habituelles s'appliquent.
Préparation
Les composés spiro présentent des défis de préparation uniques , que chaque cycle contribuant à sa structure soit unique ou identique, ou qu'ils soient carbocycliques ou hétérocycliques, en raison des implications pratiques de la tétrafonctionnalisation de l'atome spiro central (souvent avec quatre groupes différents), et de les aspects uniques de la chiralité qui s'appliquent à ces composés.
Méthodes spécifiques
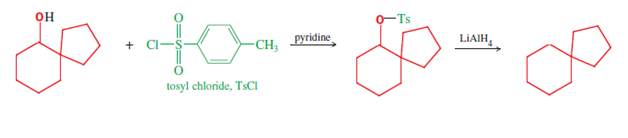
Certains composés spiro peuvent être synthétisés en utilisant le réarrangement Pinacol-pinacolone ; par exemple, le spiro[4.5]décane (composé final dans le schéma à deux lignes suivant) peut être synthétisé à partir de 1,2-diols symétriques du type indiqué ci-dessous [par exemple, le matériau de départ de cette voie, (1,1′-bicyclopentyl)-1 ,1′-diol]. Initialement, l'un des fragments carbinol est protoné, laissant l'eau s'échapper et produisant le carbocation correspondant (deuxième structure, première rangée); cet intermédiaire subit alors une migration de liaison, entraînant une expansion du cycle adjacent, avec déprotionation démasquant la fonction cétone pour compléter la première ligne du mécanisme. Ce premier produit, une cétone spirobicyclique, est un composé spiro à part entière, et donne le spiro carbinol supplémentaire et l' hydrocarbure spiro alicyclique après deux autres réactions de réduction . Premièrement, la réduction du carbonyle qui termine la première ligne du mécanisme fournit le matériau de départ spiro carbinol de la deuxième ligne, qui est nécessaire pour la réduction en alcane (illustré). Cette dernière réduction est réalisée à l'aide d'hydrure de lithium et d'aluminium (LiAlH 4 ), via le tosylate d' alcool (formé à l'aide de chlorure de tosyle ). Par conséquent, cette séquence de trois réactions fournit trois composés spiro (cétone, alcool et alcane), d'une recherche possible ou d'une utilisation pratique.
Les usages
Les formes spiro de lactones et d' oxazines sont fréquemment utilisées comme colorants leuco , présentant fréquemment un chromisme - un changement structurel réversible entre les formes donnant lieu à des apparences incolores et colorées, en particulier en solution.
Spiroaromaticité
La spiroaromaticité en chimie organique fait référence à un cas particulier d' aromaticité dans lequel la conjugaison est interrompue par un seul spiroatome. Bien que ce centre spiro perturbe le chevauchement continu des orbitales p , traditionnellement considéré comme une exigence d'aromaticité, une stabilité thermodynamique considérable et de nombreuses propriétés spectroscopiques, magnétiques et chimiques associées aux composés aromatiques sont encore observées pour ces composés.
Étymologie
Un composé spiro , ou spirane , du latin spīra , signifiant une torsion ou une bobine, est un composé chimique , généralement un composé organique , qui présente une structure torsadée de deux ou plusieurs anneaux (un système d'anneaux), dans lequel 2 ou 3 anneaux sont liés entre eux par un atome commun, dont des exemples sont montrés à droite.
Lectures complémentaires
- Clayden, Jonathan ; Greeves, Nick et Warren, Stuart (2012). Chimie organique (2e éd.). Oxford, Royaume-Uni : Oxford University Press. pp. 319f, 432, 604np, 653, 746int, 803cétal, 839, 846f. ISBN 978-0199270293. Récupéré le 2 février 2016 .CS1 maint : utilise le paramètre auteurs ( lien )
- Eliel, Ernest Ludwig; Wilen, Samuel H. & Mander, Lewis N. (1994). "Chiralité dans les molécules dépourvues de centres chiraux (chapitre 14)" . Stéréochimie des composés organiques (1ère éd.). New York, NY, États-Unis : Wiley & Sons. pp. 1119-1190, en particulier. 1119ff, 1138ff et passim . ISBN 978-0471016700. Récupéré le 2 février 2016 .CS1 maint : utilise le paramètre auteurs ( lien )Pour une autre source mais moins stable du même texte qui donne accès au matériel pertinent, voir [4] , même date d'accès.
- Exemples de produits naturels spiro et leur synthèse : Smith, Laura K. & Baxendale, Ian R. (2015). "Synthèses totales de produits naturels contenant des spirocarbocycles" . Org. Biomol. Chem . 13 (39) : 9907-9933. doi : 10.1039/C5OB01524C . PMID 26356301 .
-
Rios, Ramon (2012). « Méthodologies énantiosélectives pour la synthèse de composés Spiro ». Chem. Soc. Rev. (imprimé, en ligne)
|format=nécessite|url=( aide ) . 41 (3) : 1060-1074. doi : 10.1039/C1CS15156H . PMID 21975423 . - Les documents IUPAC sur la dénomination des composés spiro : Moss, GP et le Groupe de travail de l'Union internationale de chimie pure et appliquée [IUPAC], Division de la chimie organique, Commission sur la nomenclature de la chimie organique (III.1) (1999). "L'extension et la révision de la nomenclature des composés Spiro (IUPAC Recommendations1999)" (PDF) . Appl pur. Chem. 71 (3) : 531-558. doi : 10.1351/pac199971030531 . ISSN 1365-3075 . S2CID 20131819 . Consulté le 3 février 2016 .CS1 maint : utilise le paramètre auteurs ( lien )La liste complète des auteurs (Groupe de travail) et un lien vers une traduction allemande sont fournis dans une note de bas de page correspondante. Également disponible en ligne sur "Extension and Revision of the Nomenclature for Spiro Compounds" . Londres, GBR : Université Queen Mary de Londres., même date d'accès.