Hérédité épigénétique transgénérationnelle - Transgenerational epigenetic inheritance
L'hérédité épigénétique transgénérationnelle est la transmission de marqueurs épigénétiques d'un organisme à l'autre (c'est-à-dire du parent à l'enfant) qui affecte les traits de la progéniture sans altérer la structure primaire de l' ADN (c'est-à-dire la séquence de nucléotides), en d'autres termes, épigénétiquement . Le terme moins précis « hérédité épigénétique » peut couvrir à la fois le transfert d'informations cellule-cellule et organisme-organisme. Bien que ces deux niveaux d'hérédité épigénétique soient équivalents chez les organismes unicellulaires , ils peuvent avoir des mécanismes distincts et des distinctions évolutives chez les organismes multicellulaires .
Les facteurs environnementaux peuvent induire les marques épigénétiques (étiquettes épigénétiques) pour certains traits épigénétiquement influencés, alors que certaines marques sont héréditaires, amenant ainsi certains à considérer qu'avec l'épigénétique, la biologie moderne ne rejette plus l' héritage des caractéristiques acquises (lamarckisme) aussi fortement qu'autrefois. fait.
Catégories épigénétiques
Quatre catégories générales de modification épigénétique sont connues :
- des boucles métaboliques auto-entretenues, dans lesquelles un ARNm ou un produit protéique d'un gène stimule la transcription du gène ; par exemple le gène Wor1 chez Candida albicans ;
- des modèles structurels dans lesquels les structures sont répliquées à l'aide d'un modèle ou d'une structure d'échafaudage sur le parent ; par exemple l'orientation et l'architecture des structures cytosquelettiques, les cils et flagelles, les prions , les protéines qui se répliquent en changeant la structure des protéines normales pour correspondre à la leur ;
- les marques de chromatine , dans lesquelles les groupes méthyle ou acétyle se lient aux nucléotides ou aux histones de l' ADN , modifiant ainsi les modèles d'expression des gènes ; par exemple le gène Lcyc dans Linaria vulgaris décrit ci-dessous;
- Silençage de l'ARN , dans lequel de petits brins d'ARN interfèrent ( ARNi ) avec la transcription de l'ADN ou la traduction de l'ARNm ; connu seulement de quelques études, principalement chez Caenorhabditis elegans .
Héritage des marques épigénétiques
Bien qu'il existe diverses formes d'héritage des marqueurs épigénétiques, l'héritage des marqueurs épigénétiques peut être résumé comme la diffusion d'informations épigénétiques au moyen de la lignée germinale. En outre, la variation épigénétique prend généralement l'une des quatre formes générales, bien qu'il existe d'autres formes qui doivent encore être élucidées. Actuellement, les boucles de rétroaction auto-entretenues, la modélisation spatiale, le marquage de la chromatine et les voies médiées par l'ARN modifient les épigènes des cellules individuelles. La variation épigénétique au sein des organismes multicellulaires est soit endogène, soit exogène. L'endogène est généré par la signalisation cellule-cellule (par exemple au cours de la différenciation cellulaire au début du développement), tandis que l'exogène est une réponse cellulaire aux signaux environnementaux.
Retrait vs rétention
Chez les organismes à reproduction sexuée, une grande partie de la modification épigénétique au sein des cellules est réinitialisée pendant la méiose (par exemple, les marques au locus FLC contrôlant la vernalisation des plantes), bien que certaines réponses épigénétiques se soient avérées être conservées (par exemple, la méthylation des transposons chez les plantes). L'hérédité différentielle des marques épigénétiques dues à des biais maternels ou paternels sous-jacents dans les mécanismes d'élimination ou de rétention peut conduire à l'attribution d'une causalité épigénétique à certains effets parentaux d'origine chez les animaux et les plantes.
Reprogrammation
Chez les mammifères, les marques épigénétiques sont effacées pendant deux phases du cycle de vie. D'une part juste après la fécondation et d'autre part, dans les cellules germinales primordiales en développement, précurseurs des futurs gamètes. Au cours de la fécondation, les gamètes mâles et femelles se rejoignent dans différents états du cycle cellulaire et avec une configuration différente du génome. Les marques épigénétiques du mâle sont rapidement diluées. Premièrement, les protamines associées à l'ADN mâle sont remplacées par des histones du cytoplasme de la femelle , dont la plupart sont acétylées en raison soit d'une plus grande abondance d'histones acétylées dans le cytoplasme de la femelle, soit par liaison préférentielle de l'ADN mâle aux histones acétylées. Deuxièmement, l'ADN mâle est systématiquement déméthylé dans de nombreux organismes, peut-être par l'intermédiaire de la 5-hydroxyméthylcytosine . Cependant, certaines marques épigénétiques, notamment la méthylation de l'ADN maternel, peuvent échapper à cette reprogrammation ; conduisant à l'empreinte parentale.
Dans les cellules germinales primordiales (CPG), il y a un effacement plus étendu de l'information épigénétique. Cependant, certains sites rares peuvent également échapper à l'effacement de la méthylation de l'ADN. Si les marques épigénétiques échappent à l'effacement lors des événements de reprogrammation zygotique et PGC, cela pourrait permettre un héritage épigénétique transgénérationnel.
La reconnaissance de l'importance de la programmation épigénétique pour l'établissement et la fixation de l'identité de la lignée cellulaire au cours de l'embryogenèse précoce a récemment stimulé l'intérêt pour l'élimination artificielle de la programmation épigénétique. Manipulations épigénétiques peuvent permettre la restauration de la totipotence dans les cellules souches ou de cellules plus généralement, généralisant ainsi la médecine régénérative .
Rétention
Les mécanismes cellulaires peuvent permettre la co-transmission de certaines marques épigénétiques. Au cours de la réplication, les ADN polymérases travaillant sur les brins avant et arrière sont couplées par le facteur de processivité de l'ADN proliférant l'antigène nucléaire des cellules (PCNA), qui a également été impliqué dans la structuration et la diaphonie des brins qui permet la fidélité de copie des marques épigénétiques. Les travaux sur la fidélité de copie de modification des histones sont restés au stade du modèle, mais les premiers efforts suggèrent que les modifications des nouvelles histones sont calquées sur celles des anciennes histones et que les nouvelles et les anciennes histones s'assortissent au hasard entre les deux brins d'ADN filles. En ce qui concerne le transfert à la génération suivante, de nombreuses marques sont supprimées comme décrit ci-dessus. Des études émergentes découvrent des modèles de conservation épigénétique à travers les générations. Par exemple, les satellites centromériques résistent à la déméthylation. Le mécanisme responsable de cette conservation n'est pas connu, bien que certaines preuves suggèrent que la méthylation des histones peut y contribuer. Un dérèglement du moment de la méthylation du promoteur associé au dérèglement de l'expression génique dans l'embryon a également été identifié.
Carie
Alors que le taux de mutation dans un gène de 100 bases donné peut être de 10 -7 par génération, les épigènes peuvent "muter" plusieurs fois par génération ou peuvent être fixés pour de nombreuses générations. Cela soulève la question : les changements de fréquences épigènes constituent-ils une évolution ? Des effets épigénétiques qui se dégradent rapidement sur les phénotypes (c'est-à-dire qui durent moins de trois générations) peuvent expliquer une partie de la variation résiduelle des phénotypes après la prise en compte du génotype et de l'environnement. Cependant, distinguer ces effets à court terme des effets de l'environnement maternel sur l' ontogénie précoce reste un défi.
Contribution aux phénotypes
L'importance relative de l'hérédité génétique et épigénétique est sujette à débat. Bien que des centaines d'exemples de modification épigénétique des phénotypes aient été publiés, peu d'études ont été menées en dehors du laboratoire. Par conséquent, les interactions des gènes et des épigènes avec l'environnement ne peuvent être inférées malgré le rôle central de l'environnement dans la sélection naturelle. Les méthodologies expérimentales pour manipuler les mécanismes épigénétiques sont naissantes (par exemple) et auront besoin d'une démonstration rigoureuse avant que des études testant explicitement les contributions relatives du génotype, de l'environnement et de l'épigénotype soient réalisables.
Dans les plantes

Des études concernant l'hérédité épigénétique transgénérationnelle chez les plantes ont été rapportées dès les années 1950. L'un des exemples les plus anciens et les mieux caractérisés est la paramutation b1 chez le maïs. Le gène b1 code pour un facteur de transcription basique hélice-boucle-hélice qui est impliqué dans la voie de production des anthocyanes . Lorsque le gène b1 est exprimé, la plante accumule de l'anthocyane dans ses tissus, entraînant une coloration violette de ces tissus. L'allèle BI (pour B-Intense) a une expression élevée de b1 entraînant une pigmentation foncée des tissus de la gaine et de l'enveloppe tandis que l'allèle B' (prononcé B-prime) a une faible expression de b1 entraînant une faible pigmentation dans ces tissus. Lorsque des parents homozygotes BI sont croisés avec des homozygotes B', les descendants F1 résultants présentent tous une faible pigmentation qui est due au silençage génique de b1. De manière inattendue, lorsque les plantes F1 sont auto-croisées, la génération F2 résultante présente toutes une faible pigmentation et de faibles niveaux d'expression de b1. De plus, lorsqu'une plante F2 (y compris celles qui sont génétiquement homozygotes pour BI) est croisée avec une BI homozygote, la progéniture affichera une faible pigmentation et une faible expression de b1. L'absence d'individus à pigmentation foncée dans la descendance F2 est un exemple d' hérédité non mendélienne et d'autres recherches ont suggéré que l'allèle BI est converti en B' via des mécanismes épigénétiques. Les allèles B' et BI sont considérés comme des épiallèles car ils sont identiques au niveau de la séquence d'ADN mais diffèrent au niveau de la méthylation de l' ADN , de la production d' ARNsi et des interactions chromosomiques au sein du noyau. De plus, les plantes défectueuses en composants de la voie de méthylation de l'ADN dirigée par l' ARN montrent une expression accrue de b1 chez les individus B' similaire à celle de BI, cependant, une fois ces composants restaurés, la plante revient à l'état de faible expression. Bien qu'une conversion spontanée de BI à B' ait été observée, une réversion de B' à BI (vert à violet) n'a jamais été observée sur 50 ans et des milliers de plantes dans les expériences en serre et en champ.
Des exemples d'hérédité épigénétique transgénérationnelle induite par l'environnement chez les plantes ont également été rapportés. Dans un cas, les plants de riz qui ont été exposés à des traitements de simulation de sécheresse ont montré une tolérance accrue à la sécheresse après 11 générations d'exposition et de propagation par descendance de graines uniques par rapport aux plants non traités par la sécheresse. Les différences de tolérance à la sécheresse étaient liées à des changements directionnels dans les niveaux de méthylation de l'ADN dans tout le génome, suggérant que les changements héréditaires induits par le stress dans les modèles de méthylation de l'ADN peuvent être importants dans l'adaptation aux stress récurrents. Dans une autre étude, les plantes qui ont été exposées à un herbivore modéré par les chenilles sur plusieurs générations ont montré une résistance accrue à l'herbivorie dans les générations suivantes (mesurée par la masse sèche de la chenille) par rapport aux plantes sans pression herbivore. Cette augmentation de la résistance des herbivores a persisté après une génération de croissance sans aucune exposition aux herbivores, ce qui suggère que la réponse a été transmise à travers les générations. Le rapport a conclu que les composants de la voie de méthylation de l'ADN dirigée par l'ARN sont impliqués dans l'augmentation de la résistance à travers les générations.
Chez l'homme
Bien que l'héritage génétique soit important pour décrire les résultats phénotypiques , il ne peut pas expliquer entièrement pourquoi la progéniture ressemble à ses parents. Mis à part les gènes, la progéniture hérite de conditions environnementales similaires établies par les générations précédentes. Un environnement que la progéniture humaine partage généralement pendant neuf mois est l' utérus . Compte tenu de la durée des stades de développement fœtal , l'environnement de l'utérus de la mère peut avoir des effets durables sur la santé de la progéniture. Un exemple de la façon dont l'environnement dans l'utérus peut affecter la santé d'une progéniture est l'hiver de la faim aux Pays-Bas et son effet causal sur les maladies génétiques épigénétiques transgénérationnelles induites. Un certain nombre d'études suggèrent l'existence d'un héritage épigénétique transgénérationnel chez l'homme, qui comprend la famine hollandaise de 1944-1945 . Pendant l'hiver de famine hollandais, la progéniture née pendant la famine était plus petite que celle née l'année avant la famine. Les effets de cette famine sur le développement ont duré jusqu'à deux générations. De plus, la progéniture née pendant la famine présentait un risque accru d' intolérance au glucose à l'âge adulte. Une méthylation différentielle de l'ADN a été trouvée chez des descendants femelles adultes qui avaient été exposés à la famine in utero, mais on ne sait pas si ces différences de méthylation de l'ADN ont été transmises à leur lignée germinale. Il est supposé que l'inhibition du gène PIM3 peut avoir causé un métabolisme plus lent dans les générations ultérieures, mais la causalité n'a pas été prouvée, seulement une corrélation. Le phénomène est parfois appelé syndrome hollandais de la faim et de l'hiver . En outre, l'augmentation des taux de maladies métaboliques , les maladies cardio - vasculaires et d' autres facteurs accrus de risque pour la santé de la F1 et F2 générations au cours de l'hiver de la faim néerlandaise est un phénomène connu appelé « programmation fœtale » , qui est causée par l' exposition à des facteurs environnementaux néfastes dans utero. Une autre étude a émis l'hypothèse que des changements épigénétiques sur le chromosome Y pourraient expliquer les différences de durée de vie parmi les descendants masculins de prisonniers de guerre de la guerre de Sécession .
L' étude Överkalix a noté des effets spécifiques au sexe ; un indice de masse corporelle (IMC) plus élevé à 9 ans chez les fils, mais pas les filles, de pères qui ont commencé à fumer tôt. L'alimentation du grand-père paternel n'était liée qu'à la mortalité RR des petits-fils et non des petites-filles. L'approvisionnement alimentaire de la grand-mère paternelle n'était associé qu'au rapport de risque de mortalité des petites-filles. Lorsque la grand-mère disposait d'un bon approvisionnement alimentaire était associée à une mortalité deux fois plus élevée (RR). Cet héritage transgénérationnel a été observé avec une exposition pendant la période de croissance lente (SGP). Le SGP est la période précédant le début de la puberté , lorsque les facteurs environnementaux ont un impact plus important sur le corps. Le SGP des ancêtres dans cette étude a été établi entre 9 et 12 ans pour les garçons et entre 8 et 10 ans pour les filles. Cela s'est produit dans le SGP des deux grands-parents, ou pendant la période de gestation /la vie infantile des grands-mères, mais pas pendant la puberté de l'un ou l'autre des grands-parents. La mauvaise alimentation du père et la bonne alimentation de la mère étaient associées à un risque plus faible de décès cardiovasculaire .
La perte d'expression génétique qui entraîne le syndrome de Prader-Willi ou le syndrome d'Angelman s'est avérée dans certains cas causée par des changements épigénétiques (ou « épimutations ») sur les deux allèles , plutôt que par une quelconque mutation génétique . Dans les 19 cas informatifs, les épimutations qui, associées à l'empreinte physiologique et donc au silence de l'autre allèle , étaient à l'origine de ces syndromes étaient localisées sur un chromosome d'origine parentale et grand-parentale spécifique. Plus précisément, le chromosome d'origine paternelle portait une marque maternelle anormale au SNURF-SNRPN , et cette marque anormale était héritée de la grand-mère paternelle.
De même, des épimutations sur le gène MLH1 ont été trouvées chez deux individus avec un phénotype de cancer colorectal héréditaire sans polypose , et sans aucune mutation franche MLH1 qui causerait autrement la maladie. Les mêmes épimutations ont également été trouvées sur les spermatozoïdes de l'un des individus, indiquant le potentiel d'être transmis à la progéniture.
En plus des épimutations du gène MLH1 , il a été déterminé que certains cancers, tels que le cancer du sein , peuvent survenir pendant les stades fœtaux dans l' utérus . De plus, les preuves recueillies dans diverses études utilisant des systèmes modèles (c'est-à-dire des animaux) ont montré que l'exposition au cours des générations parentales peut entraîner une transmission multigénérationnelle et transgénérationnelle du cancer du sein. Plus récemment, des études ont découvert un lien entre l'adaptation des cellules germinales mâles via les régimes paternels préconceptionnels et la régulation du cancer du sein chez la progéniture en développement. Plus précisément, des études ont commencé à découvrir de nouvelles données qui soulignent une relation entre l'hérédité épigénétique transgénérationnelle du cancer du sein et les composants alimentaires ancestraux ou les marqueurs associés , tels que le poids à la naissance. En utilisant des systèmes modèles, tels que des souris, des études ont montré que l'obésité paternelle stimulée au moment de la conception peut altérer épigénétiquement la lignée germinale paternelle. La lignée germinale paternelle est responsable de la régulation du poids de leurs filles à la naissance et du risque que leur fille développe un cancer du sein. En outre, il a été constaté que les modifications du profil d' expression des miARN de la lignée germinale mâle sont associées à un poids corporel élevé. De plus, l'obésité paternelle a entraîné une augmentation du pourcentage de progénitures femelles développant des tumeurs mammaires induites par des cancérogènes , qui sont causées par des modifications de l'expression du miARN mammaire.
Mis à part les afflictions liées au cancer associées aux effets de l'hérédité épigénétique transgénérationnelle, l'hérédité épigénétique transgénérationnelle a récemment été impliquée dans la progression de l'hypertension artérielle pulmonaire (HTAP). Des études récentes ont montré que l'hérédité épigénétique transgénérationnelle est susceptible d'être impliquée dans la progression de l'HTAP parce que les thérapies actuelles pour l'HTAP ne réparent pas les phénotypes irréguliers associés à cette maladie. Les traitements actuels de l'HTAP ont tenté de corriger les symptômes de l'HTAP avec des vasodilatateurs et des protecteurs antithrombotiques , mais aucun n'a efficacement atténué les complications liées aux phénotypes altérés associés à l'HTAP. L'incapacité des vasodilatateurs et des protecteurs antithrombotiques à corriger l'HTAP suggère que la progression de l'HTAP dépend de plusieurs variables, ce qui est probablement la conséquence de l'hérédité épigénétique transgénérationnelle. Plus précisément, on pense que l'épigénétique transgénérationnelle est liée aux changements phénotypiques associés au remodelage vasculaire . Par exemple, l' hypoxie pendant la gestation peut induire des altérations épigénétiques transgénérationnelles qui pourraient s'avérer préjudiciables pendant les premières phases du développement fœtal et augmenter la possibilité de développer une HTAP à l'âge adulte. La prise en compte des effets potentiels de l'épigénétique transgénérationnelle au cours du développement fœtal découle de l' hypothèse des origines fœtales de la maladie de l'adulte (FOAD), qui est liée au concept de programmation fœtale . Bien que les états hypoxiques puissent induire la variance épigénétique transgénérationnelle associée à l'HTAP, il existe des preuves solides pour soutenir qu'une variété de facteurs de risque maternels sont liés à la progression éventuelle de l'HTAP. Ces facteurs de risque maternels liés à l'HTAP d'apparition tardive comprennent la dysfonction placentaire, l'hypertension, l'obésité et la prééclampsie. Ces facteurs de risque maternels et facteurs de stress environnementaux couplés à des changements épigénétiques transgénérationnels peuvent entraîner une atteinte prolongée aux voies de signalisation associées au développement vasculaire pendant les stades fœtaux, augmentant ainsi la probabilité d'avoir une HTAP.
Une étude a montré que la maltraitance infantile, définie comme « un contact sexuel, une violence physique grave et/ou une négligence grave », entraîne des modifications épigénétiques de l'expression des récepteurs des glucocorticoïdes. L'expression des récepteurs glucocorticoïdes joue un rôle vital dans l'activité hypothalamo-hypophyso-surrénale (HPA). De plus, des expérimentations animales ont montré que les changements épigénétiques peuvent dépendre des interactions mère-enfant après la naissance. De plus, une étude récente portant sur les corrélations entre le stress maternel pendant la grossesse et la méthylation chez les adolescentes/leurs mères a révélé que les enfants de femmes qui ont été maltraitées pendant la grossesse étaient plus susceptibles d'avoir des gènes récepteurs des glucocorticoïdes méthylés. Ainsi, les enfants porteurs de gènes récepteurs de glucocorticoïdes méthylés subissent une réponse altérée au stress, conduisant finalement à une plus grande susceptibilité à l'anxiété.
Des études supplémentaires examinant les effets du diéthylstilbestrol (DES), qui est un perturbateur endocrinien , ont révélé que les petits-enfants (troisième génération) de femmes exposées au DES augmentaient considérablement la probabilité que leurs petits - enfants développent un trouble déficitaire de l'attention/hyperactivité (TDAH). En effet, les femmes exposées à des perturbateurs endocriniens , tels que le DES, pendant la gestation peuvent être liées à des déficits neurodéveloppementaux multigénérationnels . De plus, des études animales indiquent que les perturbateurs endocriniens ont un impact profond sur les cellules germinales et le développement neurologique. La cause de l'impact multigénérationnel du DES est postulée comme étant le résultat de processus biologiques associés à la reprogrammation épigénétique de la lignée germinale , bien que cela reste à déterminer.
Effets sur la condition physique
L'hérédité épigénétique ne peut affecter la valeur adaptative que si elle modifie de manière prévisible un trait sélectionné. Des preuves ont été avancées que les stimuli environnementaux sont des agents importants dans l'altération des épigènes. Ironiquement, l'évolution darwinienne peut agir sur ces caractéristiques acquises néo-lamarckiennes ainsi que sur les mécanismes cellulaires qui les produisent (par exemple les gènes de la méthyltransférase). L'hérédité épigénétique peut conférer un avantage de fitness aux organismes qui font face aux changements environnementaux à des échelles de temps intermédiaires. Les changements à cycle court sont susceptibles d'avoir des processus de régulation codés par l'ADN, car la probabilité que la progéniture ait besoin de répondre aux changements plusieurs fois au cours de leur vie est élevée. D'un autre côté, la sélection naturelle agira sur les populations subissant des changements sur des changements environnementaux à cycle plus long. Dans ces cas, si l' amorçage épigénétique de la génération suivante est délétère pour la fitness sur la majeure partie de l'intervalle (par exemple, la désinformation sur l'environnement), ces génotypes et épigénotypes seront perdus. Pour les cycles de temps intermédiaires, la probabilité que la progéniture rencontre un environnement similaire est suffisamment élevée sans pression sélective substantielle sur les individus dépourvus d'une architecture génétique capable de répondre à l'environnement. Naturellement, les longueurs absolues des cycles environnementaux courts, intermédiaires et longs dépendront du trait, de la durée de la mémoire épigénétique et du temps de génération de l'organisme. Une grande partie de l'interprétation des effets de fitness épigénétique se concentre sur l'hypothèse que les épigènes sont des contributeurs importants aux phénotypes, ce qui reste à résoudre.
Effets délétères
Les marques épigénétiques héritées peuvent être importantes pour réguler des composants importants de la condition physique. Chez les plantes, par exemple, le gène Lcyc de Linaria vulgaris contrôle la symétrie de la fleur. Linnaeus a d' abord décrit des mutants à symétrie radiale, qui apparaissent lorsque Lcyc est fortement méthylé. Étant donné l'importance de la forme florale pour les pollinisateurs, la méthylation d' homologues Lcyc (par exemple CYCLOIDEA ) peut avoir des effets délétères sur la santé des plantes. Chez l'animal, de nombreuses études ont montré que les marques épigénétiques héréditaires peuvent augmenter la susceptibilité à la maladie. Il est également suggéré que les influences épigénétiques transgénérationnelles contribuent à la maladie, en particulier au cancer, chez l'homme. Il a été démontré que les modèles de méthylation tumorale dans les promoteurs de gènes sont en corrélation positive avec les antécédents familiaux de cancer. De plus, la méthylation du gène MSH2 est corrélée aux cancers colorectaux et endométriaux d'apparition précoce.
Effets putativement adaptatifs
Les graines déméthylées expérimentalement de l' organisme modèle Arabidopsis thaliana ont une mortalité significativement plus élevée, une croissance rabougrie, une floraison retardée et une nouaison plus faible, ce qui indique que les épigènes peuvent augmenter la valeur adaptative. De plus, il a été démontré que les réponses épigénétiques au stress induites par l'environnement sont héréditaires et corrélées positivement avec la fitness. Chez les animaux, la nidification communautaire modifie le comportement de la souris en augmentant les régimes de soins parentaux et les capacités sociales supposées augmenter la survie de la progéniture et l'accès aux ressources (telles que la nourriture et les partenaires), respectivement.
Modèles macro-évolutifs
Les effets épigénétiques héréditaires sur les phénotypes ont été bien documentés chez les bactéries, les protistes, les champignons, les plantes, les nématodes et les mouches des fruits. Bien qu'aucune étude systématique de l'hérédité épigénétique n'ait été menée (la plupart se concentrent sur des organismes modèles), il existe des preuves préliminaires que ce mode d'hérédité est plus important chez les plantes que chez les animaux. La différenciation précoce des lignées germinales animales est susceptible d'empêcher le marquage épigénétique se produisant plus tard dans le développement, tandis que chez les plantes et les champignons, les cellules somatiques peuvent être incorporées dans la lignée germinale.
On pense que l'héritage épigénétique transgénérationnel peut permettre à certaines populations de s'adapter facilement à des environnements variables. Bien qu'il existe des cas bien documentés d'hérédité épigénétique transgénérationnelle dans certaines populations, on se demande si cette même forme d'adaptabilité est applicable aux mammifères. Plus précisément, on se demande si cela s'applique aux humains. Ces derniers temps, la plupart des modèles expérimentaux utilisant des souris et des observations limitées chez l'homme n'ont trouvé que des traits hérités épigénétiquement qui sont préjudiciables à la santé des deux organismes. Ces traits nocifs vont d'un risque accru de maladie, comme les maladies cardiovasculaires , à la mort prématurée. Cependant, cela peut être basé sur la prémisse d'un biais de déclaration limité, car il est plus facile de détecter des effets expérimentaux négatifs, par opposition aux effets expérimentaux positifs. De plus, une reprogrammation épigénétique considérable nécessaire au succès évolutif des lignées germinales et aux phases initiales de l' embryogenèse chez les mammifères pourrait être la cause potentielle limitant l'héritage transgénérationnel des marques de chromatine chez les mammifères.
Les modèles d' histoire de vie peuvent également contribuer à l'occurrence d'hérédité épigénétique. Les organismes sessiles , ceux qui ont une faible capacité de dispersion et ceux qui ont un comportement simple peuvent bénéficier le plus de la transmission d'informations à leur progéniture via des voies épigénétiques. Des modèles géographiques peuvent également émerger, où des environnements hautement variables et hautement conservés pourraient abriter moins d'espèces avec un héritage épigénétique important.
Controverses
Les humains ont depuis longtemps reconnu que les traits des parents sont souvent observés chez la progéniture. Cette idée a conduit à l'application pratique de l'élevage sélectif de plantes et d'animaux, mais n'a pas abordé la question centrale de l'héritage : comment ces traits sont-ils conservés entre les générations et quelles sont les causes de la variation ? Plusieurs positions ont été tenues dans l'histoire de la pensée évolutionniste.
Mélange contre héritage particulaire
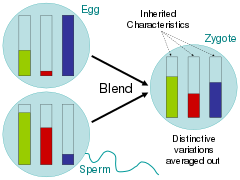
Répondant à ces questions connexes, les scientifiques de l'époque des Lumières ont largement plaidé en faveur de l'hypothèse du mélange, dans laquelle les traits parentaux étaient homogénéisés chez la progéniture, un peu comme des seaux de peinture de différentes couleurs mélangés ensemble. Les critiques de l'Origine des espèces de Charles Darwin ont souligné que sous ce schéma d'hérédité, la variation serait rapidement submergée par le phénotype majoritaire. Dans l'analogie du pot de peinture, cela se verrait en mélangeant deux couleurs ensemble, puis en mélangeant la couleur résultante avec une seule des couleurs parentes 20 fois ; la couleur de la variante rare s'estomperait rapidement.
Inconnu de la majeure partie de la communauté scientifique européenne, le moine Gregor Mendel avait résolu la question de la conservation des caractères entre les générations grâce à des expériences de sélection de plants de pois. Charles Darwin ne connaissait donc pas l'« héritage particulaire » proposé par Mendel dans lequel les traits n'étaient pas mélangés mais transmis à la progéniture en unités discrètes que nous appelons maintenant gènes. Darwin en est venu à rejeter l'hypothèse du mélange même si ses idées et celles de Mendel n'ont été unifiées que dans les années 1930, une période appelée la synthèse moderne .
Hérédité des caractéristiques innées vs acquises
Dans son livre de 1809, Philosophie Zoologique , Jean-Baptiste Lamarck a reconnu que chaque espèce connaît un ensemble unique de défis en raison de sa forme et de son environnement. Ainsi, il a proposé que les caractères utilisés le plus souvent accumuleraient un « fluide nerveux ». Ces accumulations acquises seraient alors transmises à la descendance de l'individu. En termes modernes, un fluide nerveux transmis à la progéniture serait une forme d'hérédité épigénétique.
Le lamarckisme , comme ce corps de pensée est devenu connu, était l'explication standard du changement d'espèces au fil du temps lorsque Charles Darwin et Alfred Russel Wallace ont co-proposé une théorie de l'évolution par sélection naturelle en 1859. Répondant à la théorie de Darwin et Wallace, une révision néo -Le lamarckisme a attiré un petit nombre de biologistes, bien que le zèle lamarckien ait été éteint en grande partie grâce à la célèbre expérience de Weismann dans laquelle il a coupé les queues de souris sur plusieurs générations successives sans avoir d'effet sur la longueur de la queue. Ainsi, le consensus émergent selon lequel les caractéristiques acquises ne pouvaient pas être héritées est devenu canon.
Révision de la théorie de l'évolution
Cependant, la variation et l'hérédité non génétiques se sont avérées assez courantes. Parallèlement au développement au XXe siècle de la synthèse évolutive moderne (unifiant la génétique mendélienne et la sélection naturelle), CH Waddington (1905-1975) travaillait à unifier la biologie et la génétique du développement . Ce faisant, il a adopté le mot « épigénétique » pour représenter la différenciation ordonnée des cellules embryonnaires en types cellulaires fonctionnellement distincts malgré la structure primaire identique de leur ADN. Les chercheurs ont discuté de l'épigénétique de Waddington de manière sporadique - elle est devenue plus un fourre-tout pour dérouter les caractères héréditaires non génétiques plutôt qu'un concept faisant avancer le corps de l'enquête. Par conséquent, la définition du mot de Waddington a elle-même évolué, s'élargissant au-delà du sous-ensemble de la spécialisation cellulaire héritée signalée par le développement.
Certains scientifiques se sont demandé si l'hérédité épigénétique compromettait le fondement de la synthèse moderne. Décrivant le dogme central de la biologie moléculaire , Francis Crick succinctement indiqué, « ADN est maintenu dans une configuration par histone [s] de manière à pouvoir agir en tant que matrice passive pour la synthèse simultanée de l' ARN et des protéines [s]. Aucun de détail « l'information » est dans l'histone. » Cependant, il ferme l'article en déclarant : « ce schéma explique la majorité des résultats expérimentaux actuels ! En effet, l'émergence de l'hérédité épigénétique (en plus des progrès dans l'étude du développement évolutif, de la plasticité phénotypique , de l'évolutivité et de la biologie des systèmes) a mis à rude épreuve le cadre actuel de la synthèse évolutive moderne, et a incité le réexamen des théories évolutives précédemment rejetées. mécanismes.
De plus, les modèles d'héritage épigénétique et les implications évolutives des codes épigénétiques dans les organismes vivants sont liés aux théories de l'évolution de Lamarck et de Darwin . Par exemple, Lamarck a postulé que les facteurs environnementaux étaient responsables de la modification héréditaire des phénotypes , ce qui soutient les constructions selon lesquelles l'exposition aux facteurs environnementaux pendant les étapes critiques du développement peut entraîner des épimutations dans les lignées germinales , augmentant ainsi la variance phénotypique. En revanche, la théorie de Darwin prétendait que la sélection naturelle renforçait la capacité des populations à survivre et à rester en bonne santé reproductive en favorisant les populations capables de s'adapter facilement. Cette théorie est cohérente avec la plasticité intergénérationnelle et la variance phénotypique résultant de l'adaptabilité héréditaire.
De plus, une certaine variabilité épigénétique peut fournir une plasticité bénéfique , de sorte que certains organismes peuvent s'adapter à des conditions environnementales fluctuantes. Cependant, l'échange d'informations épigénétiques entre générations peut entraîner des aberrations épigénétiques, qui sont des traits épigénétiques qui s'écartent de la norme. Par conséquent, la progéniture des générations parentales peut être prédisposée à des maladies spécifiques et à une plasticité réduite en raison d'aberrations épigénétiques. Bien que la capacité de s'adapter facilement face à un nouvel environnement puisse être bénéfique pour certaines populations d'espèces capables de se reproduire rapidement, les espèces avec de longs écarts générationnels peuvent ne pas bénéficier d'une telle capacité. Si une espèce avec un écart générationnel plus long ne s'adapte pas de manière appropriée à l'environnement prévu, alors la capacité de reproduction de la progéniture de cette espèce sera diminuée.
Edward J Steele , Robyn A Lindley et ses collègues, Fred Hoyle et N. Chandra Wickramasinghe , Yongsheng Liu Denis Noble , John Mattick et d'autres ont discuté de manière critique de la théorie de l'évolution traditionnelle selon laquelle les incohérences logiques ainsi que les effets de l'héritage lamarckien impliquant l'ADN direct modifications, ainsi que l'indirecte qui vient d'être décrite, à savoir. épigénétique, transmiss'ions, défient la pensée conventionnelle en biologie évolutive et dans les domaines adjacents.
Voir également
- Contribution des modifications épigénétiques à l'évolution
- étude verkalix
- Famine hollandaise de 1944-1945#Legacy
- Héritage du stress transgénérationnel

