UGT2B7 - UGT2B7
L' UGT2B7 (UDP-Glucuronosyltransférase-2B7) est une isoenzyme du métabolisme de phase II qui s'avère active dans le foie , les reins , les cellules épithéliales du tractus gastro-intestinal inférieur et a également été signalée dans le cerveau . Chez l'homme, l'UDP-Glucuronosyltransférase-2B7 est codée par le gène UGT2B7 .
Fonction
Les UGT jouent un rôle majeur dans la conjugaison et l'élimination subséquente des xénobiotiques potentiellement toxiques et des composés endogènes. L'UGT2B7 a une spécificité unique pour les œstrogènes 3,4- catéchols et l' œstriol , ce qui suggère qu'il pourrait jouer un rôle important dans la régulation du niveau et de l'activité de ces puissants métabolites d'œstrogènes.
Cette enzyme est située sur le réticulum endoplasmique et les membranes nucléaires des cellules. Sa fonction est de catalyser la conjugaison d'une grande variété de substrats lipophiles d' aglycones avec l'acide glucuronique , en utilisant l'acide uridine diphosphate glucuronique .
Avec l' UGT2B4 , l'UGT2B7 est capable de glucosidation de l' acide hyodésoxycholique dans le foie, mais, contrairement à l'isoforme 2B4, 2B7 est également capable de glucuronider diverses hormones stéroïdes ( androstérone , épitestostérone ) et acides gras . Il est également capable de conjuguer les principales classes de médicaments tels que les analgésiques ( morphine ), les anti-inflammatoires non stéroïdiens carboxyliques ( kétoprofène ) et les anticarcinogènes ( acide tout-trans rétinoïque ). L'UGT2B7 est la principale isoforme enzymatique responsable du métabolisme de la morphine , de la codéine , de la norcodéine et d'autres opiacés en leurs 3- et 6-glucuronides correspondants. Par exemple, le métabolisme de la morphine produit de la morphine-3-glucuronide (M3G) qui n'a pas d'effet analgésique et de la morphine-6-glucuronide (M6G), qui a des effets analgésiques plus puissants que la morphine. En conséquence, une activité UGT2B7 altérée peut affecter de manière significative à la fois l'efficacité et les effets secondaires de la morphine, ainsi que de certains médicaments opiacés apparentés.
Structure
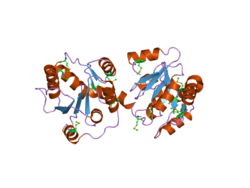
Aucune structure d'une enzyme UGT humaine complète n'a encore été déterminée, cependant Miley et al. résolu une structure UGT2B7 partielle de la partie C-terminale montrant deux domaines dimères avec des plis de type Rossman dans un complexe. Le pli Rossman lie généralement les substrats nucléotidiques , dans ce cas le cofacteur acide UDP-glucuronique impliqué dans la glucuronidation par UGT2B7. Généralement, l' extrémité C-terminale des enzymes UGT est hautement conservée et se lie au cofacteur acide UDP-glucuronique, tandis que l' extrémité N-terminale (non résolue dans cette structure) est responsable de la liaison au substrat. Cette première structure résolue indiquait que l'extrémité C-terminale de l'un des deux dimères se projetait dans le site de liaison à l' acide UDP-glucuronique du deuxième dimère, rendant ainsi le deuxième dimère inefficace.
D'autres études ont étudié la dimérisation des polymorphismes enzymatiques de l'UGT et ont trouvé que la formation d'homodimères et d'hétérodimères (avec des polymorphismes génétiques de l'UGT2B7 ou d'autres enzymes UGT telles que l'UGT1A1) est possible, certaines combinaisons ayant un effet sur l'activité enzymatique.
Polymorphisme génétique
UGT2B7 est considéré comme un gène hautement polymorphe. Divers efforts de recherche ont étudié l'effet potentiel de ces variantes polymorphes sur l' activité de glucuronidation de l'UGT2B7 et en particulier sa clairance des médicaments administrés , y compris les thérapies anticancéreuses. Une activité de glucuronidation réduite par la variante génétique de l'UGT2B7 pourrait entraîner une toxicité accrue en raison des niveaux élevés du médicament restant ou s'accumulant dans les organes d'un patient, en particulier le foie, tandis qu'une activité accrue pourrait signifier une efficacité moindre du traitement administré en raison de niveaux inférieurs aux attentes dans le corps.
Une étude a révélé que les travailleurs de l'industrie de la teinture chinoise Han exposés à la benzidine étaient plus à risque de développer un cancer de la vessie s'ils avaient le polymorphisme nucléotidique unique (SNP) UGT2B7 C802T codant His268Tyr. La mutation histidine en tyrosine au niveau du résidu 268 est située dans la partie N-terminale de l'UGT2B7, qui se lie au substrat xénobiotique par opposition à l'extrémité C-terminale qui se lie à l'acide UDP-glucuronique. Le mécanisme spéculé de ce risque accru de cancer impliquait une augmentation de la glucuronidation de la benzidine par le mutant UGT2B7, suivie d'un clivage de la benzidine glucuronidée aux niveaux de pH de l'urine, libérant des concentrations plus élevées de benzidine dans la vessie. Une autre étude a recherché une association similaire entre la variante UGT2B7 G900A et le risque de cancer colorectal, mais n'a trouvé aucune association significative.
Une étude de la clairance de l' erlotinib chez des patients atteints d' un cancer du poumon non à petites cellules n'a montré aucune signification statistique pour les SNP de l'UGT2B7, qui métabolise potentiellement l'erlotinib, comme indiqué par l'inhibition par l'erlotinib de l'UGT2B7. Une enquête sur la clairance du diclofénac , un anti-inflammatoire non stéroïdien (AINS) qui peut provoquer de graves lésions hépatiques d' origine médicamenteuse , a montré que le mutant UGT2B7 avec le SNP C802T avait une clairance du diclofénac 6 fois inférieure à celle de l' UGT27B de type sauvage, contribuant peut-être à une toxicité hépatique accrue chez les patients porteurs de cette mutation. L'analyse des polymorphismes génétiques de l'UGT2B7 dans les lésions hépatiques induites par les médicaments antituberculeux (ATLI) n'a trouvé aucune association entre les mutations de l'UGT2B7 et de l'ATLI dans la population étudiée.
L'UGT2B7 est également connue pour être impliquée dans le métabolisme des opioïdes via la glucuronidation, et une étude portant sur l'effet des polymorphismes sur l' efficacité analgésique de la buprénorphine a révélé que la mutation C802T aggravait considérablement la réponse analgésique à la buprénorphine après une chirurgie thoracique , en particulier à plus long terme. points (48 heures) où cet opioïde de longue durée est censé rester efficace. Cette même variante s'est avérée séparément avoir des effets significatifs sur la concentration plasmatique d' acide valproïque administrée aux patients épileptiques , ce qui peut expliquer une partie de la variabilité individuelle observée avec ce traitement à fenêtre thérapeutique étroite . Ces deux cas indiquent une diminution des concentrations de composé médicamenteux probablement due à une activité de glucuronidation accrue de l'UGT2B7 avec le polymorphisme C802T.
Étant donné que l'UGT2B7 est impliquée dans la glucuronidation de nombreux composés xénobiotiques et que les polymorphismes de l'UGT2B7 sont répandus, l'étude des effets potentiels des polymorphismes de l'UGT2B7 sur la clairance des composés pharmacologiquement pertinents est souvent intéressante, comme le montre la variété des études entreprises. Le polymorphisme UGT2B7 C802T, par exemple, a été noté à 73 % de prévalence chez les Asiatiques et à 46 % de prévalence chez les Caucasiens ; par conséquent, les effets de ce polymorphisme pourraient avoir un impact sur une grande partie de la population. Cependant, toutes les études ne trouvent pas de changements significatifs dans la clairance dus à ces polymorphismes génétiques. Il n'est pas toujours clair si cela est dû au polymorphisme particulier n'affectant pas l'activité enzymatique de l'UGT2B7, ou parce que le composé d'intérêt est métabolisé par diverses voies qui peuvent masquer les différences dues aux changements d'activité de l'UGT2B7.
Les références
Lectures complémentaires
- Kwara A, Lartey M, Boamah I, Rezk NL, Oliver-Commey J, Kenu E, Kashuba AD, Court MH (septembre 2009). « Variabilité interindividuelle de la pharmacocinétique des inhibiteurs génériques de la transcriptase inverse nucléosidiques chez les patients ghanéens co-infectés par la tuberculose/le VIH : l'UGT2B7*1c est associée à une clairance et à une glucuronidation plus rapides de la zidovudine » . Journal de pharmacologie clinique . 49 (9) : 1079-1090. doi : 10.1177/0091270009338482 . PMC 2749505 . PMID 19628728 .
- Hwang MS, Lee SJ, Jeong HE, Lee S, Yoo MA, Shin JG (2010). « Variations génétiques du gène UDP-glucuronosyltransférase 2B7 (UGT2B7) dans une population coréenne ». Métabolisme des médicaments et pharmacocinétique . 25 (4) : 398-402. doi : 10.213/dmpk.DMPK-10-SC-021 . PMID 20814162 .
- Rose JE, Behm FM, Drgon T, Johnson C, Uhl GR (2010). « Sevrage tabagique personnalisé : interactions entre dose de nicotine, dépendance et score génotypique de réussite au sevrage » . Médecine Moléculaire . 16 (7-8): 247-53. doi : 10.2119/molmed.2009.00159 . PMC 2896464 . PMID 20379614 .
- Holmes MV, Shah T, Vickery C, Smeeth L, Hingorani AD, Casas JP (décembre 2009). « Tenir la promesse de la médecine personnalisée ? Revue systématique et synopsis de terrain des études pharmacogénétiques » . PLOS UN . 4 (12) : e7960. Bibcode : 2009PLoSO ... 4.7960H . doi : 10.1371/journal.pone.0007960 . PMC 2778625 . PMID 19956635 .
- Kwara A, Lartey M, Sagoe KW, Kenu E, Court MH (octobre 2009). "Les polymorphismes génétiques CYP2B6, CYP2A6 et UGT2B7 sont des prédicteurs de la concentration à dose moyenne d'éfavirenz chez les patients infectés par le VIH" . SIDA . 23 (16) : 2101–6. doi : 10.1097/QAD.0b013e3283319908 . PMC 2875867 . PMID 19779319 .
- Setlur SR, Chen CX, Hossain RR, Ha JS, Van Doren VE, Stenzel B, Steiner E, Oldridge D, Kitabayashi N, Banerjee S, Chen JY, Schäfer G, Horninger W, Lee C, Rubin MA, Klocker H, Demichelis F (janvier 2010). "Variation génétique des gènes impliqués dans le métabolisme de la dihydrotestostérone et le risque de cancer de la prostate" (PDF) . Épidémiologie du cancer, biomarqueurs et prévention . 19 (1) : 229–39. doi : 10.1158/1055-9965.EPI-09-1018 . PMID 20056642 . S2CID 11725521 .
- Sánchez MB, Herranz JL, Leno C, Arteaga R, Oterino A, Valdizán EM, Nicolás JM, Adín J, Armijo JA (mars 2010). « Facteurs génétiques associés à la pharmacorésistance de l'épilepsie : pertinence de la stratification selon l'âge du patient et l'étiologie de l'épilepsie » . Saisie . 19 (2) : 93-101. doi : 10.1016/j.seizure.2009.12.004 . PMID 20064729 . S2CID 17525536 .
- Chen M, LeDuc B, Kerr S, Howe D, Williams DA (mars 2010). "Identification de l'UGT2B7 humain comme isoforme majeure impliquée dans la O-glucuronidation du chloramphénicol". Métabolisme et élimination des drogues . 38 (3) : 368–75. doi : 10.1124/dmd.109.029900 . PMID 20008037 . S2CID 10438280 .
- Ross CJ, Katzov-Eckert H, Dubé MP, Brooks B, Rassekh SR, Barhdadi A, Feroz-Zada Y, Visscher H, Brown AM, Rieder MJ, Rogers PC, Phillips MS, Carleton BC, Hayden MR (décembre 2009). « Les variantes génétiques de la TPMT et de la COMT sont associées à une perte auditive chez les enfants recevant une chimiothérapie au cisplatine ». Génétique de la nature . 41 (12) : 1345–9. doi : 10.1038/ng.478 . PMID 19898482 . S2CID 21293339 .
- Tang L, Ye L, Singh R, Wu B, Lv C, Zhao J, Liu Z, Hu M (juin 2010). "Utilisation des empreintes digitales de glucuronidation pour décrire et prédire le métabolisme des mono- et dihydroxyflavones par des isoformes UGT recombinantes et des microsomes intestinaux et hépatiques humains" . Pharmaceutique Moléculaire . 7 (3) : 664–79. doi : 10.1021/mp900223c . PMC 2941766 . PMID 20297805 .
- Woillard JB, Rerolle JP, Picard N, Rousseau A, Drouet M, Munteanu E, Essig M, Marquet P, Le Meur Y (juin 2010). « Risque de diarrhée dans une cohorte à long terme de patients transplantés rénaux recevant du mycophénolate mofétil : le rôle important de l'allèle variant UGT1A8 2 » . Journal britannique de pharmacologie clinique . 69 (6) : 675-83. doi : 10.1111/j.1365-2125.2010.03625.x . PMC 2883760 . PMID 20565459 .
- Yu L, Qian M, Liu Y, Yao T, Zeng S (mai 2010). « Métabolisme stéréosélectif de la glucuronidation du propranolol par les UDP-glucuronosyltransférases humaines 2B7 et 1A9 ». Chiralité . 22 (4) : 456-61. doi : 10.1002/chir.20765 . PMID 19644937 .
- Yang JW, Lee PH, Hutchinson IV, Pravica V, Shah T, Min DI (octobre 2009). « Polymorphismes génétiques de MRP2 et UGT2B7 et symptômes gastro-intestinaux chez les receveurs de greffe rénale prenant de l'acide mycophénolique ». Surveillance thérapeutique des médicaments . 31 (5) : 542-8. doi : 10.1097/FTD.0b013e3181b1dd5e . PMID 19730281 . S2CID 6454841 .
- Ahn J, Schumacher FR, Berndt SI, Pfeiffer R, Albanes D, Andriole GL, Ardanaz E, Boeing H, Bueno-de-Mesquita B, Chanock SJ, Clavel-Chapelon F, Diver WR, Feigelson HS, Gaziano JM, Giovannucci E , Haiman CA, Henderson BE, Hoover RN, Kolonel LN, Kraft P, Ma J, Le Marchand L, Overvad K, Palli D, Stattin P, Stampfer M, Stram DO, Thomas G, Thun MJ, Travis RC, Trichopoulos D, Virtamo J, Weinstein SJ, Yeager M, Kaaks R, Hunter DJ, Hayes RB (octobre 2009). "Loci de traits quantitatifs prédisant les hormones stéroïdes sexuelles circulantes chez les hommes du NCI-Breast and Prostate Cancer Cohort Consortium (BPC3)" . Génétique Moléculaire Humaine . 18 (19) : 3749-57. doi : 10.1093/hmg/ddp302 . PMC 2742399 . PMID 19574343 .
- Hu M, Lui SS, Mak VW, Chu TT, Lee VW, Poon EW, Tsui TK, Ko GT, Baum L, Tam LS, Li EK, Tomlinson B (octobre 2010). « Analyse pharmacogénétique des réponses lipidiques à la rosuvastatine chez les patients chinois ». Pharmacogénétique et génomique . 20 (10) : 634-7. doi : 10.1097/FPC.0b013e32833de489 . PMID 20679960 . S2CID 3475599 .
- Zhao W, Fakhoury M, Deschênes G, Roussey G, Brochard K, Niaudet P, Tsimaratos M, André JL, Cloarec S, Cochat P, Bensman A, Azougagh S, Jacqz-Aigrain E (novembre 2010). "Population pharmacokinetics et pharmacogénétique de l'acide mycophénolique suite à l'administration de mycophénolate mofétil chez les patients pédiatriques transplantés rénaux de novo". Journal de pharmacologie clinique . 50 (11) : 1280–91. doi : 10.1177/0091270009357429 . PMID 20147615 . S2CID 22875166 .
- Blanca Sánchez M, Herranz JL, Leno C, Arteaga R, Oterino A, Valdizán EM, Nicolas JM, Adín J, Shushtarian M, Armijo JA (avril 2010). « Le polymorphisme UGT2B7_-161C>T est associé au rapport concentration-dose de lamotrigine dans une étude multivariée ». Surveillance thérapeutique des médicaments . 32 (2) : 177-84. doi : 10.1097/FTD.0b013e3181ceecc6 . hdl : 10261/49808 . PMID 20216122 . S2CID 44807993 .
- Yong M, Schwartz SM, Atkinson C, Makar KW, Thomas SS, Newton KM, Aiello Bowles EJ, Holt VL, Leisenring WM, Lampe JW (février 2010). « Associations entre les polymorphismes des enzymes de glucuronidation et de sulfatation et la densité mammaire mammographique chez les femmes préménopausées aux États-Unis » . Épidémiologie du cancer, biomarqueurs et prévention . 19 (2) : 537–46. doi : 10.1158/1055-9965.EPI-09-0898 . PMC 2820123 . PMID 20142249 .
- Joy MS, Boyette T, Hu Y, Wang J, La M, Hogan SL, Stewart PW, Falk RJ, Dooley MA, Smith PC (novembre 2010). « Effets de la pharmacogénomique de l'uridine diphosphate glucuronosyltransférase 2B7 et 1A7 et des paramètres cliniques des patients sur la pharmacocinétique de l'acide mycophénolique à l'état d'équilibre dans la glomérulonéphrite » . Journal Européen de Pharmacologie Clinique . 66 (11) : 1119–30. doi : 10.1007/s00228-010-0846-x . PMC 3739695 . PMID 20567810 .
Liens externes
- human+UGT2B7 à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis
- UGT2B7+protéine,+humain à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis
- "GT2B7" . PharmaGKB . PharmaGKB . Récupéré le 13-01-2009 .