Oxianion - Oxyanion
Un oxyanion , ou oxoanion , est un ion de formule générique A
XOz −
y(où A représente un élément chimique et O représente un atome d' oxygène ). Les oxyanions sont formés par une grande majorité des éléments chimiques . Les formules des oxyanions simples sont déterminées par la règle de l' octet . L' oxyacide correspondant d'un oxyanion est le composé H
zUNE
XO
oui. Les structures des oxyanions condensés peuvent être rationalisées en termes d' unités polyédriques AO n avec partage de coins ou d'arêtes entre polyèdres. Les oxyanions (plus précisément, les esters de phosphate et de polyphosphate) l'adénosine monophosphate ( AMP ), l'adénosine diphosphate ( ADP ) et l' adénosine triphosphate ( ATP ) sont importants en biologie.
Oxyanions monomères
La formule des oxyanions monomères , AOm −
n, est dicté par l' état d' oxydation de l' élément A et sa position dans le tableau périodique . Les éléments de la première rangée sont limités à un nombre de coordination maximum de 4. Cependant, aucun des éléments de la première rangée n'a d'oxyanion monomère avec ce numéro de coordination. Au lieu de cela, le carbonate ( CO2−
3) et les nitrates ( NON−
3) ont une structure plane trigonale avec une liaison entre l'atome central et les atomes d'oxygène. Cette liaison est favorisée par la similitude de taille de l'atome central et de l'oxygène.
Les oxyanions des éléments de la deuxième rangée à l' état d'oxydation du groupe sont tétraédriques . SiO tétraédrique
4les unités se trouvent dans les minéraux d' olivine , [Mg,Fe]SiO
4, mais l'anion n'a pas d'existence séparée car les atomes d'oxygène sont entourés de manière tétraédrique par des cations à l'état solide. Phosphate ( PO3−
4), sulfate ( SO2−
4), et le perchlorate ( ClO−
4) peuvent être trouvés tels quels dans divers sels. De nombreux oxyanions d'éléments à l'état d'oxydation inférieur obéissent à la règle de l' octet et cela peut être utilisé pour rationaliser les formules adoptées. Par exemple, le chlore (V) a deux électrons de valence, il peut donc accueillir trois paires d'électrons provenant de liaisons avec des ions oxyde. La charge sur l'ion est +5 − 3 × 2 = −1, et donc la formule est ClO−
3. La structure de l'ion est prédite par la théorie VSEPR comme étant pyramidale, avec trois paires d'électrons de liaison et une paire isolée. De manière similaire, l'oxyanion de chlore (III) a pour formule ClO−
2, et est plié avec deux paires isolées et deux paires de liaison.
| État d'oxydation | Nom | Formule | Image |
|---|---|---|---|
| +1 | L' ion hypochlorite | ClO − |

|
| +3 | L' ion chlorite |
ClO− 2 |

|
| +5 | L' ion chlorate |
ClO− 3 |

|
| +7 | L' ion perchlorate |
ClO− 4 |

|
Dans la troisième rangée et les suivantes du tableau périodique, la coordination 6 est possible, mais les oxyanions octaédriques isolés ne sont pas connus car ils porteraient une charge électrique trop élevée. Ainsi le molybdène(VI) ne forme pas MoO6−
6, mais forme l' anion molybdate tétraédrique , MoO2−
4. Les unités MoO 6 se trouvent dans les molybdates condensés. Des oxyanions entièrement protonés avec une structure octaédrique se trouvent dans des espèces telles que Sn(OH)2−
6et Sb(OH)−
6. De plus, l' orthoperiodate ne peut être que partiellement protoné, avec H
3OI2−
6||⇌|| H
2OI3−
6||+ H + ayant p K a = 11,60.
Appellation
La dénomination des oxyanions monomères suit les règles suivantes.
- Si l'atome central n'est pas dans le groupe VII ou VIII
| Numéro d'oxydation de l'atome central | Schéma de nommage | Exemples |
|---|---|---|
| = Numéro de groupe | *-a mangé |
Borate ( BO3− 3), Carbonate ( CO2− 3), Nitrate ( NON− 3), Phosphate ( PO3− 4), Sulfate ( SO2− 4), Chromate ( CrO2− 4), arséniate ( AsO3− 4), Ferrate ( FeO2− 4) |
| = Numéro de groupe − 2 | *-ite |
Nitrite ( NON− 2), Phosphite ( PO3− 3), Sulfite ( SO2− 3), Arsénite ( AsO3− 3) |
| = Numéro de groupe − 4 | hypo-*-ite |
Hypophosphite ( PO3− 2), Hyposulfite ( SO2− 2) |
- Si l'atome central est dans le groupe VII ou VIII
| Numéro d'oxydation de l'atome central | Schéma de nommage | Exemples |
|---|---|---|
| = Numéro de groupe | par-*-mangé |
Perchlorate ( ClO− 4), perbromate ( BrO− 4), Periodate ( IO− 4), Permanganate ( MnO− 4), Perxénate ( XeO4− 6) |
| = Numéro de groupe − 2 | *-a mangé |
Chlorate ( ClO− 3), Bromate ( BrO− 3), iodate ( IO− 3) |
| = Numéro de groupe − 4 | *-ite |
Chlorite ( ClO− 2), Bromite ( BrO− 2) |
| = Numéro de groupe − 6 | hypo-*-ite | Hypochlorite (ClO − ), Hypobromite (BrO − ) |
Réactions de condensation
En solution aqueuse, les oxyanions à forte charge peuvent subir des réactions de condensation, comme dans la formation de l' ion dichromate , Cr
2O2−
7:
- 2 CrO2−
4+ 2 H + ⇌ Cr
2O2−
7+ H 2 O
La force motrice de cette réaction est la réduction de la densité de charge électrique sur l'anion et l'élimination de l' ion H + . La quantité d'ordre dans la solution est diminuée, libérant une certaine quantité d' entropie qui rend l' énergie libre de Gibbs plus négative et favorise la réaction directe. C'est un exemple de réaction acide-base avec l'oxyanion monomère agissant comme base et l'oxyanion condensé agissant comme son acide conjugué . La réaction inverse est une réaction d' hydrolyse , car une molécule d'eau , agissant comme une base, est divisée. Une condensation supplémentaire peut se produire, en particulier avec des anions de charge plus élevée, comme cela se produit avec les phosphates d'adénosine.

|
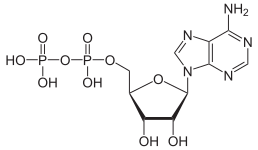
|
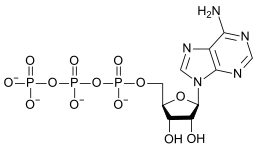
|
| CHA | ADP | ATP |
La conversion de l'ATP en ADP est une réaction d'hydrolyse et constitue une importante source d'énergie dans les systèmes biologiques.
La formation de la plupart des minéraux silicatés peut être considérée comme le résultat d'une réaction de décondensation dans laquelle la silice réagit avec un oxyde basique, une réaction acide-base au sens Lux-Flood .
- CaO (base) + SiO 2 (acide) → CaSiO 3
Structures et formules des polyoxyanions
Un polyoxyanion est un oxyanion polymère dans lequel plusieurs monomères d'oxyanion, généralement considérés comme des polyèdres MO n , sont joints en partageant des coins ou des bords. Lorsque deux coins d'un polyèdre sont partagés, la structure résultante peut être une chaîne ou un anneau. Des chaînes courtes apparaissent, par exemple, dans les polyphosphates . Les inosilicates, tels que les pyroxènes , ont une longue chaîne de tétraèdres SiO 4 partageant chacun deux coins. La même structure se produit dans ce qu'on appelle les méta-vanadates, tels que le métavanadate d'ammonium , NH 4 VO 3 .
La formule de l'oxyanion SiO2−
3s'obtient comme suit : chaque ion silicium nominal (Si 4+ ) est attaché à deux ions oxyde nominaux (O 2- ) et a une demi-part dans deux autres. Ainsi la stoechiométrie et la charge sont données par :
- Stoechiométrie: Si + 2 O + (2 x une / 2 ) O = SiO 3
- Charge : +4 + (2 × −2) + (2 × ( 1 ⁄ 2 × −2)) = −2.
Un anneau peut être considéré comme une chaîne dans laquelle les deux extrémités ont été jointes. Cyclic triphosphate , P
3O3−
9 est un exemple.
Lorsque trois coins sont partagés, la structure s'étend en deux dimensions. Dans les amphiboles , (dont l' amiante est un exemple), deux chaînes sont reliées entre elles en partageant un troisième coin à des endroits alternés le long de la chaîne. Il en résulte une formule idéale Si
4O6−
11et une structure en chaîne linéaire qui explique la nature fibreuse de ces minéraux. Le partage des trois coins peut entraîner une structure en feuille, comme dans le mica , Si
2O2−
5, dans laquelle chaque silicium a un oxygène pour lui-même et une demi-part dans trois autres. Le mica cristallin peut être clivé en feuilles très minces.
Le partage des quatre coins des tétraèdres donne une structure tridimensionnelle, comme dans le quartz . Les aluminosilicates sont des minéraux dans lesquels une partie du silicium est remplacée par de l'aluminium. Cependant, l'état d'oxydation de l'aluminium est inférieur de un à celui du silicium, le remplacement doit donc s'accompagner de l'ajout d'un autre cation. Le nombre de combinaisons possibles d'une telle structure est très important, ce qui est en partie la raison pour laquelle il existe autant d'aluminosilicates.
Les unités octaédriques MO 6 sont courantes dans les oxyanions des métaux de transition les plus gros. Certains composés, tels que les sels de l'ion polymère à chaîne, Mo
2O2−
7contiennent même à la fois des unités tétraédriques et octaédriques. Le partage des bords est courant dans les ions contenant des blocs de construction octaédriques et les octaèdres sont généralement déformés pour réduire la contrainte au niveau des atomes d'oxygène de pontage. Il en résulte des structures tridimensionnelles appelées polyoxométalates . Des exemples typiques se produisent dans la structure de Keggin de l' ion phosphomolybdate . Le partage des bords est un moyen efficace de réduire la densité de charge électrique, comme on peut le voir avec l'hypothétique réaction de condensation impliquant deux octaèdres :
- 2 MOn −
6+ 4 H + → Lun
2O( n −4)−
10+ 2 H 2 O
Ici, la charge moyenne sur chaque atome M est réduite de 2. L'efficacité du partage des bords est démontrée par la réaction suivante, qui se produit lorsqu'une solution aqueuse alcaline de molybdate est acidifiée.
- 7 MoO2−
4+ 8 H + ⇌ Mo
7O6−
24+ 4 H 2 O
L'ion molybdate tétraédrique est converti en un groupe de 7 octaèdres lié bord donnant une charge moyenne de chaque molybdène de 6 / 7 . Le cluster d'heptamolybdate est si stable que des clusters avec entre 2 et 6 unités de molybdate n'ont pas été détectés même s'ils doivent être formés comme intermédiaires.
Heuristique pour l'acidité
Le pKa des acides apparentés peut être deviné à partir du nombre de doubles liaisons à l'oxygène. Ainsi l'acide perchlorique est un acide très fort tandis que l'acide hypochloreux est très faible. Une règle simple fonctionne généralement à environ 1 unité de pH.
Propriétés acido-basiques
La plupart des oxyanions sont des bases faibles et peuvent être protonés pour donner des acides ou des sels acides. Par exemple, l'ion phosphate peut être successivement protoné pour former de l'acide phosphorique.
-
Bon de commande3−
4+ H + ⇌ HPO2−
4 -
HPO2−
4+ H + ⇌ H
2Bon de commande−
4 -
H
2Bon de commande−
4+ H + ⇌ H 3 PO 4
L'étendue de la protonation en solution aqueuse dépendra des constantes de dissociation acide et du pH . Par exemple, l'AMP (adénosine monophosphate) a une valeur d' ap K de 6,21, donc à pH 7, il sera protoné à environ 10 %. La neutralisation de charge est un facteur important dans ces réactions de protonation. En revanche, les anions monovalents perchlorate et permanganate sont très difficiles à protoner et les acides correspondants sont donc des acides forts .
Bien que les acides tels que l'acide phosphorique soient écrits H 3 PO 4 , les protons sont attachés aux atomes d'oxygène formant des groupes hydroxyle, de sorte que la formule peut également être écrite comme OP (OH) 3 pour mieux refléter la structure. L'acide sulfurique peut s'écrire O 2 S(OH) 2 ; c'est la molécule observée en phase gazeuse.
L' ion phosphite , PO3−
3, est une base forte , et porte donc toujours au moins un proton. Dans ce cas le proton est attaché directement à l'atome de phosphore avec la structure HPO2−
3. En formant cet ion, l'ion phosphite se comporte comme une base de Lewis et donne une paire d'électrons à l'acide de Lewis, H + .
Comme mentionné ci-dessus, une réaction de condensation est également une réaction acide-base. Dans de nombreux systèmes, des réactions de protonation et de condensation peuvent se produire. Le cas de l'ion chromate fournit un exemple relativement simple. Dans le diagramme de prédominance du chromate, illustré à droite, pCr représente le logarithme négatif de la concentration en chrome et pH représente le logarithme négatif de la concentration en ions H + . Il existe deux équilibres indépendants. Les constantes d'équilibre sont définies comme suit.
CrO2−
4+ H + ⇌ HcrO−
4log K 1 = 5,89 2 HCRO−
4⇌ Cr
2O2−
7+ H 2 Olog K 2 = 2,05
Le diagramme de prédominance est interprété comme suit.
- L'ion chromate, CrO2−
4, est l'espèce prédominante à pH élevé. Au fur et à mesure que le pH augmente, l'ion chromate devient de plus en plus prédominant, jusqu'à ce qu'il soit la seule espèce dans les solutions avec un pH > 6,75. - A pH < p K 1 l'ion chromate d'hydrogène, HcrO−
4 est prédominant en solution diluée. - L'ion dichromate, Cr
2O2−
7, est prédominant dans les solutions plus concentrées, sauf à pH élevé.
Les espèces H 2 CrO 4 et HCr
2O−
7 ne sont pas représentés car ils ne se forment qu'à un pH très bas.
Les diagrammes de prédominance peuvent devenir très compliqués lorsque de nombreuses espèces polymères peuvent être formées, comme dans les vanadates , les molybdates et les tungstates . Une autre complication est que bon nombre des polymères supérieurs se forment extrêmement lentement, de sorte que l'équilibre peut ne pas être atteint même en quelques mois, ce qui entraîne des erreurs possibles dans les constantes d'équilibre et le diagramme de prédominance.







![{\displaystyle K_{1}={\frac {[\mathrm {HCrO_{4}^{-}} ]}{[\mathrm {CrO_{4}^{2-}} ][\mathrm {H^{ +}} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58c28311b8a8a69931b4cfa144888a4d9e4306b1)
![K_{2}={\frac {[{\mathrm {Cr_{2}O_{7}^{{2-}}}}]}{[{\mathrm {HCrO_{4}^{-}}}] ^{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8247e0ecc828c99522eb74cce96893d4a0ca1f60)