Recherche sur la grippe - Influenza research
| Grippe (grippe) |
|---|
 |
La recherche sur la grippe consiste à étudier la virologie moléculaire , la pathogenèse , les réponses immunitaires de l' hôte , la génomique et l' épidémiologie de la grippe . Le principal objectif de la recherche est de développer des contre-mesures contre la grippe telles que des vaccins , des thérapies et des outils de diagnostic.
Au moins 12 entreprises et 17 gouvernements développent des vaccins antigrippaux pré-pandémiques dans 28 essais cliniques différents qui, s'ils réussissent, pourraient transformer une pandémie mortelle en une infection non-pandémique. Un vaccin qui pourrait prévenir toute maladie due à la souche de grippe pandémique qui n’existe pas encore prendra au moins trois mois entre l’émergence du virus et le début de la production de vaccins à grande échelle; la production de vaccins espère augmenter jusqu'à ce qu'un milliard de doses soient produites un an après la première identification du virus.
Des contre-mesures améliorées contre la grippe nécessitent des recherches de base sur la manière dont les virus pénètrent dans les cellules, se répliquent, mutent, évoluent en nouvelles souches et induisent une réponse immunitaire. Des solutions aux limites des méthodes vaccinales actuelles sont en cours de recherche.
Le projet de séquençage du génome de la grippe a été lancé en 2004 pour créer une bibliothèque de séquences de la grippe afin de comprendre ce qui rend une souche plus mortelle qu'une autre, quels déterminants génétiques affectent le plus l' immunogénicité et comment le virus évolue au fil du temps.
Domaines de recherche actuelle sur la grippe
La grippe aviaire
Avant 2004, toutes les souches précédentes du virus de la grippe aviaire hautement pathogène (IAHP) ne circulaient que parmi les volailles domestiques et en les éliminant toutes dans la zone, les souches ont été éteintes. Les souches précédentes d'HPAI n'existaient que chez les oiseaux domestiques. Le LPAI d'un oiseau sauvage muterait dans un troupeau domestique en une souche d'IAHP, tous les oiseaux domestiques de la zone seraient tués et la souche d'IAHP n'aurait plus d'hôtes et n'existerait donc plus. Cette souche actuelle d'HPAI H5N1 s'est avérée différente. En octobre 2004, des chercheurs ont découvert que le H5N1 est beaucoup plus dangereux qu'on ne le croyait auparavant parce que la sauvagine, en particulier les canards, propageait directement la souche hautement pathogène du H5N1. À partir de ce moment, les experts de la grippe aviaire ont de plus en plus fait référence à l'endiguement comme une stratégie qui peut retarder mais non empêcher une future pandémie de grippe aviaire . Néanmoins, il y a toujours l'espoir qu'elle mute en une souche faiblement pathogène au fil du temps et n'existera plus dans son ensemble actuel de souches hautement pathogènes. Mais avec le temps, l'espoir est devenu de moins en moins probable. Le résultat est que des milliards de dollars seront nécessaires chaque année pour des dépenses qui ne seraient pas nécessaires si elles disparaissaient. L'élevage de volaille est particulièrement touché. Comment utiliser au mieux les fonds d'atténuation de la pandémie et les fonds de protection de l'aviculture est une question à laquelle il faut répondre à des milliards de dollars en recherche sur la grippe et dans de nouvelles usines de fabrication de vaccins contre la grippe.
Étant donné que la grippe aviaire ne disparaît pas comme on l'espérait, davantage de données sont nécessaires pour déterminer la meilleure façon d'y faire face. Les gouvernements financent une variété d'études de la culture cellulaire des virus de la grippe à l' efficacité de la vaccination H5N1 à des adjuvants pour les modèles de migration d'oiseaux sauvages aux oiseaux sauvages distribution de sous - type de grippe aviaire à la grippe La vaccination des volailles , etc. Les informations recueillies augmente la capacité du monde à garder H5N1 contenu , limitant sa vitesse et l'étendue de la mutation, et gagner du temps pour la mise en service de nouvelles méthodes de fabrication de vaccins contre la grippe et de nouvelles usines afin que, lors de la prochaine pandémie de grippe, le nombre de morts puisse être minimisé.
Vaccins universels contre la grippe
Voir les perspectives des vaccins antigrippaux universels
Principaux contrats de recherche sur la grippe en cours
Le 4 mai 2006, le gouvernement américain a attribué des contrats de cinq ans pour "plus d'un milliard de dollars à cinq fabricants de médicaments développant une technologie pour accélérer la production de masse de vaccins en cas de pandémie" à partir du projet de loi sur la préparation à la pandémie de 3,8 milliards de dollars adopté en 2005. " Le gouvernement fédéral affirme que son objectif est de pouvoir distribuer un vaccin à tous les Américains dans les six mois suivant une pandémie. Actuellement, les vaccins antigrippaux sont produits dans des œufs de poule spécialisés , mais cette technique ne permet pas des vaccinations de masse rapides. " Les entreprises bénéficiaires des contrats étaient:
- GlaxoSmithKline 274,8 millions de dollars
- MedImmune Inc 169,5 millions de dollars
- Novartis Vaccines and Diagnostics 220,5 millions de dollars
- DynPort Vaccine Company, LLC 41 millions de dollars
- Solvay Pharmaceuticals 298,6 millions de dollars
Le gouvernement américain a acheté à Sanofi Pasteur et Chiron Corporation plusieurs millions de doses de vaccin destinées à être utilisées en cas de pandémie de grippe due au H5N1 et mène des essais cliniques sur celles-ci. ABC News a rapporté le 1er avril 2006 que «à partir de la fin de 1997, les essais sur l'homme ont testé 30 vaccins différents, tous liés au virus H5N1».
<< Pour contrer la menace H9N2 , le NIAID a conclu un contrat avec Chiron Corporation pour produire des lots expérimentaux d'un vaccin inactivé, qui seront évalués cliniquement par le NIAID au début de l'année prochaine. Pour le H5N1 , Aventis-Pasteur et Chiron produisent tous deux des lots expérimentaux de préparations de vaccin H5N1 inactivé. ; en outre, le DHHS a passé un contrat avec Aventis pour produire jusqu'à 2 millions de doses à stocker pour une utilisation d'urgence, si nécessaire, pour vacciner les agents de santé, les chercheurs et, le cas échéant, le public dans les zones touchées. Développement et évaluation d'une combinaison antivirale un régime contre ces souches potentielles de grippe pandémique est également en cours. "
Vaccins
Un vaccin ne serait probablement pas disponible aux premiers stades de l'infection de la population. Une fois qu'un virus potentiel est identifié, il faut normalement au moins plusieurs mois avant qu'un vaccin ne devienne largement disponible, car il doit être développé, testé et autorisé. La capacité de produire des vaccins varie considérablement d'un pays à l'autre; en fait, seuls 15 pays sont répertoriés comme «fabricants de vaccins contre la grippe» selon l' Organisation mondiale de la santé . On estime que, dans le meilleur scénario, 750 millions de doses pourraient être produites chaque année, alors qu'il est probable que chaque individu aurait besoin de deux doses du vaccin pour devenir immuno-compétent. La distribution vers et à l'intérieur des pays serait probablement problématique. Cependant, plusieurs pays ont des plans bien élaborés pour produire de grandes quantités de vaccins. Par exemple, les autorités sanitaires canadiennes affirment qu'elles développent la capacité de produire 32 millions de doses en quatre mois, suffisamment de vaccin pour vacciner chaque personne au pays.
Il existe deux graves problèmes techniques associés au développement d'un vaccin contre le H5N1. Le premier problème est le suivant: les vaccins contre la grippe saisonnière nécessitent une injection unique de 15 μg d'hémagglutinine pour assurer une protection; H5 semble n'évoquer qu'une faible réponse immunitaire et un vaste essai multicentrique a révélé que deux injections de 90 µg H5 à 28 jours d'intervalle n'offraient une protection que chez 54% des personnes. Même si l'on considère que 54% est un niveau de protection acceptable, le monde n'est actuellement capable de produire que 900 millions de doses à une concentration de 15 μg (en supposant que toute la production a été immédiatement convertie à la fabrication du vaccin H5); si deux injections de 90 μg sont nécessaires, cette capacité tombe à 70 millions seulement. Des essais utilisant des adjuvants tels que l' alun ou le MF59 pour essayer de réduire la dose de vaccin sont nécessaires de toute urgence. Le deuxième problème est le suivant: il existe deux clades de virus en circulation , le clade 1 est le virus isolé à l'origine au Vietnam, le clade 2 est le virus isolé en Indonésie. La recherche actuelle sur les vaccins se concentre sur les virus du clade 1, mais le virus du clade 2 est antigéniquement distinct et un vaccin du clade 1 ne protégera probablement pas contre une pandémie causée par le virus du clade 2.
Une tactique qui peut être utilisée pour accélérer la validation des vaccins consiste à examiner de manière contrôlée le déclenchement des réponses immunitaires à la provocation vaccinale. Une approche pour appliquer cette tactique a été signalée en 2013, dans laquelle une puce électronique de protéine d' hémagglutinine a été utilisée pour examiner la réponse à un vaccin antigrippal.
Vaccin antigrippal vivant atténué
En Juin 2007, le National Institutes of Health (NIH) a commencé à inscrire les participants à une étude H5N1 phase 1 d'un intranasale vaccin contre la grippe candidat en fonction Flumist , MedImmune de vivant atténué la technologie des vaccins .
Génétique inversée
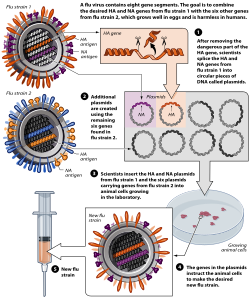
Une technique appelée génétique inverse permet aux scientifiques de manipuler les génomes des virus grippaux et de transférer des gènes entre les souches virales . La technique permet la génération rapide de virus de semence pour des vaccins candidats qui correspondent exactement à la souche épidémique anticipée . En supprimant ou en modifiant certains gènes de virulence, la génétique inverse peut également être utilisée pour convertir des virus grippaux hautement pathogènes en vaccins candidats plus sûrs à manipuler pour les fabricants de vaccins.
Culture de cellules
Une autre technique consiste à utiliser des cultures cellulaires pour cultiver des souches vaccinales; comme le baculovirus génétiquement modifié pour exprimer un gène qui code pour une protéine d'enveloppe de la grippe telle que l' hémagglutinine ou la neuraminidase . << Un récent essai clinique de phase II soutenu par le NIAID d'un vaccin produit par Protein Sciences Corporation utilisant cette stratégie a montré qu'il est bien toléré et immunogène; la société mène une évaluation clinique plus approfondie de ce produit. D'autres nouvelles voies de production de vaccins contre la grippe comprennent l'ADN. et le développement de vaccins largement protecteurs basés sur des protéines du virus de la grippe partagées par plusieurs souches. "
AVI Bio Pharma Inc. a des preuves de l'inhibition de plusieurs sous-types de virus de la grippe A en culture cellulaire avec des oligomères Morpholino à partir des résultats de leurs laboratoires et de quatre laboratoires de recherche indépendants. "La principale conclusion ici est que nos produits thérapeutiques NEUGENE (R) continuent de montrer leur efficacité contre toutes les souches de la grippe A, y compris H5N1 ." Les morpholinos conjugués à des peptides pénétrant dans les cellules se sont révélés efficaces pour protéger les souris de la grippe A.
«Plusieurs entreprises se concentrent sur de nouveaux véhicules pour la culture d' antigènes , qui sont les fragments d'un virus ou d'une bactérie nécessaires pour stimuler le système immunitaire d' une personne pour lutter contre une infection. VaxInnate , une société de biotechnologie basée dans le New Jersey , a fait état de succès en utilisant E. coli bactéries, qui peuvent provoquer une infection parfois mortelle, mais peuvent également être utilisées pour faire pousser des ingrédients de vaccins lorsque la partie nocive de la bactérie est éliminée. Dowpharma , une unité de Dow Chemical , utilise différentes bactéries présentes dans le sol et l'eau, P. fluorescens , qui peuvent produire un volume plus élevé d'antigènes plus rapidement que E. coli. " De plus, un vaccin appelé FluBlOk, fabriqué à partir de cellules d'insectes, a reçu l'approbation de la FDA en janvier 2013. Ce vaccin, qui se concentre sur l' hémagglutinine , réduirait le processus de production d'un à deux mois, tout en évitant d'autres écueils des œufs de poule.
"Le comité des médicaments à usage humain (CHMP), qui examine les demandes de 27 pays de l'UE, a constaté que le vaccin Optaflu de Novartis , administré à plus de 3 400 personnes au cours des études cliniques, répondait aux critères d'immunogénicité du CHMP [...] Novartis a déclaré que Optaflu est un vaccin sous - unité, ce qui signifie qu'il contient des protéines virales individuelles plutôt que de particules entières de virus. [...] Novartis a dit qu'il prévoit une demande de US licence en 2008. de son vaccin contre la grippe à base de cellules La société phase de conduite 1 et 2 cliniques essais du vaccin aux États-Unis et en juillet 2006, il a annoncé qu’il construirait une usine de 600 millions de dollars à Holly Springs , en Caroline du Nord , pour fabriquer des vaccins antigrippaux par culture cellulaire. En mai 2006, le ministère de la Santé et des Services sociaux des États-Unis a attribué à Novartis un contrat de 220 millions de dollars pour développer des vaccins antigrippaux à base de cellules, et Novartis a déclaré que l'argent servirait au coût de la nouvelle installation. Selon le moment où son vaccin est approuvé par le Food and Drug Adm des États-Unis inistration (FDA), l'usine pourrait commencer la production dès 2011 et être prêt pour la pleine production dès 2012, avec une production annuelle de 50 millions de doses d'un vaccin trivalent, la compagnie a dit. En cas de pandémie de grippe, l'installation est conçue pour avoir la capacité de prendre jusqu'à 150 millions de doses monovalentes (souche unique) chaque année dans les 6 mois suivant une déclaration de pandémie, a déclaré Novartis. L'autre installation de production de vaccins à base de cellules de Novartis se trouve à Marburg , en Allemagne . "
Planification du vaccin contre la grippe pandémique
Selon l' Annexe F du Plan de lutte contre la grippe pandémique du ministère de la Santé et des Services sociaux des États-Unis (HHS): Activités actuelles du HHS révisées pour la dernière fois le 8 novembre 2005:
- À l'heure actuelle, le vaccin antigrippal pour le programme annuel de lutte contre la grippe saisonnière provient de quatre fabricants. Cependant, un seul fabricant produit le vaccin annuel entièrement aux États-Unis. Ainsi, si une pandémie se produisait et que la capacité de fabrication de vaccins antigrippaux aux États-Unis était complètement détournée vers la production d'un vaccin contre la pandémie, l'offre serait sévèrement limitée. De plus, comme le processus annuel de fabrication de la grippe a lieu pendant la majeure partie de l'année, le temps et la capacité de produire un vaccin contre les virus pandémiques potentiels pour un stock, tout en continuant la production annuelle de vaccin contre la grippe, sont limités. Étant donné que l'offre sera limitée, il est essentiel que le HHS puisse diriger la distribution des vaccins conformément à des groupes prédéfinis (voir l' annexe D ); Le HHS assurera le renforcement des capacités et engagera les États dans une discussion sur l'achat et la distribution du vaccin contre la grippe pandémique.
- Capacité de production de vaccins: La réponse immunitaire protectrice générée par les vaccins antigrippaux actuels est largement basée sur les antigènes viraux de l' hémagglutinine (HA) et de la neuraminidase (NA) dans le vaccin. En conséquence, la base de la fabrication de vaccins contre la grippe est la croissance de quantités massives de virus afin d'avoir des quantités suffisantes de ces antigènes protéiques pour stimuler les réponses immunitaires. Les vaccins antigrippaux utilisés aux États-Unis et dans le monde sont fabriqués en faisant pousser des virus dans des œufs de poule fécondés , un processus commercial en place depuis des décennies. Pour atteindre les objectifs actuels de production de vaccins, des millions d'œufs fécondés âgés de 11 jours doivent être disponibles chaque jour de production.
- À court terme, une nouvelle expansion de ces systèmes fournira une capacité supplémentaire pour la production aux États-Unis de vaccins saisonniers et pandémiques, cependant, la capacité de pointe qui sera nécessaire pour une réponse pandémique ne peut être satisfaite par la seule production de vaccins à base d'œufs. , car il n'est pas pratique de développer un système qui dépend de centaines de millions d'œufs spécialisés âgés de 11 jours en attente. De plus, comme une pandémie pourrait résulter d'une souche de grippe aviaire mortelle pour les poulets , il est impossible de garantir que des œufs seront disponibles pour produire le vaccin en cas de besoin.
- En revanche, la technologie de fabrication de cultures cellulaires peut être appliquée aux vaccins antigrippaux comme c'est le cas avec la plupart des vaccins viraux (par exemple, vaccin contre la polio, vaccin contre la rougeole - oreillons - rubéole, vaccin contre la varicelle ). Dans ce système, les virus sont cultivés dans des systèmes fermés tels que des bioréacteurs contenant un grand nombre de cellules dans des milieux de croissance plutôt que dans des œufs. La capacité de surtension offerte par la technologie cellulaire est insensible aux saisons et peut être ajustée à la demande de vaccins, car la capacité peut être augmentée ou diminuée par le nombre de bioréacteurs ou le volume utilisé dans un bioréacteur. En plus de soutenir la recherche fondamentale sur le développement de vaccins antigrippaux à base de cellules, HHS soutient actuellement un certain nombre de fabricants de vaccins dans le développement avancé de vaccins antigrippaux à base de cellules dans le but de développer des vaccins antigrippaux cellulaires homologués aux États-Unis et produits aux États-Unis. États.
- Technologies d'économie de dose. Les vaccins actuellement homologués aux États-Unis stimulent une réponse immunitaire basée sur la quantité d' antigène HA ( hémagglutinine ) incluse dans la dose. Des méthodes pour stimuler une forte réponse immunitaire en utilisant moins d'antigène HA sont à l'étude dans les essais de vaccins H5N1 et H9N2 . Celles-ci comprennent le changement du mode d'administration de l'intramusculaire à l'intradermique et l'ajout d'adjuvant renforçant le système immunitaire à la formulation du vaccin. En outre, HHS sollicite des propositions de contrat auprès des fabricants de vaccins, d' adjuvants et de dispositifs médicaux pour le développement et l'homologation de vaccins contre la grippe qui fourniront des stratégies alternatives d'économie de dose.
Recherche sur le vaccin H5N1
 |
Il existe plusieurs vaccins H5N1 pour plusieurs des variétés aviaires H5N1. H5N1 mute continuellement les rendant, jusqu'à présent pour les humains, de peu d'utilité. Bien qu'il puisse y avoir une certaine protection croisée contre les souches de grippe apparentées, la meilleure protection serait d'un vaccin spécifiquement produit pour toute future souche de virus de la grippe pandémique. Daniel R. Lucey , codirecteur du programme d'études supérieures sur les menaces biologiques et les maladies émergentes à l'Université de Georgetown, a fait valoir ce point: "Il n'y a pas de pandémie H5N1 , donc il ne peut y avoir de vaccin contre la pandémie ." Cependant, des «vaccins prépandémiques» ont été créés; sont en cours de raffinement et de test; et ont des promesses à la fois dans la poursuite de la recherche et la préparation à la prochaine pandémie. Les entreprises de fabrication de vaccins sont encouragées à accroître leurs capacités afin que, si un vaccin pandémique est nécessaire, des installations soient disponibles pour la production rapide de grandes quantités d'un vaccin spécifique à une nouvelle souche pandémique.
Les problèmes liés à la production de vaccins H5N1 comprennent:
- manque de capacité de production globale
- manque de capacité de production de pointe (il est impossible de développer un système qui dépend de centaines de millions d'œufs spécialisés âgés de 11 jours en attente)
- la pandémie H5N1 pourrait être mortelle pour les poulets
La technologie de fabrication de la culture cellulaire (à base de cellules) peut être appliquée aux vaccins antigrippaux comme c'est le cas avec la plupart des vaccins viraux et ainsi résoudre les problèmes associés à la création de vaccins antigrippaux en utilisant des œufs de poule, comme c'est le cas actuellement. Des chercheurs de l'Université de Pittsburgh ont eu du succès avec un vaccin génétiquement modifié qui n'a pris qu'un mois à fabriquer et a complètement protégé les poulets contre le virus hautement pathogène H5N1 .
Selon le ministère de la Santé et des Services sociaux des États-Unis :
- En plus de soutenir la recherche fondamentale sur le développement de vaccins antigrippaux cellulaires, HHS soutient actuellement un certain nombre de fabricants de vaccins dans le développement avancé de vaccins antigrippaux cellulaires dans le but de développer des vaccins antigrippaux cellulaires homologués aux États-Unis. États. Technologies d'économie de dose. Les vaccins actuellement homologués aux États-Unis stimulent une réponse immunitaire basée sur la quantité d' antigène HA ( hémagglutinine ) incluse dans la dose. Des méthodes pour stimuler une forte réponse immunitaire en utilisant moins d'antigène HA sont à l'étude dans les essais de vaccins H5N1 et H9N2. Celles-ci comprennent le changement du mode d'administration de l'intramusculaire à l'intradermique et l'ajout d' adjuvant renforçant le système immunitaire à la formulation du vaccin. En outre, HHS sollicite des propositions de contrat de la part des fabricants de vaccins , d' adjuvants et de dispositifs médicaux pour le développement et l'homologation de vaccins contre la grippe qui fourniront des stratégies alternatives d'économie de dose.
Chiron Corporation est maintenant recertifiée et sous contrat avec les National Institutes of Health pour produire de 8 000 à 10 000 doses expérimentales de vaccin contre la grippe aviaire (H5N1) . Aventis Pasteur est sous contrat similaire. [1] Le gouvernement des États-Unis espère obtenir suffisamment de vaccin en 2006 pour traiter 4 millions de personnes. Cependant, on ne sait pas si ce vaccin serait efficace contre une souche mutée hypothétique qui serait facilement transmise par les populations humaines, et la durée de conservation des doses stockées reste à déterminer.
Le New England Journal of Medicine a rendu compte le 30 mars 2006 de l'une des dizaines d'études sur les vaccins actuellement en cours. Le Treanor et al. étude portait sur un vaccin produit à partir de l'isolat humain (A / Vietnam / 1203/2004 H5N1 ) d'un virus virulent de la grippe A (H5N1) de clade 1 avec l'utilisation d'un système de sauvetage plasmidique, avec seulement les gènes d'hémagglutinine et de neuraminidase exprimés et administrés sans adjuvant. "Le reste des gènes provient d'une souche avirulente de grippe A / PR / 8/34 adaptée aux œufs. Le gène de l'hémagglutinine a été modifié pour remplacer six acides aminés basiques associés à une pathogénicité élevée chez les oiseaux au site de clivage entre l'hémagglutinine 1 et hémagglutinine 2. L'immunogénicité a été évaluée par des essais de microneutralisation et d'hémagglutination-inhibition avec l'utilisation du virus vaccinal, bien qu'un sous-groupe d'échantillons ait été testé avec l'utilisation du virus de la grippe sauvage A / Vietnam / 1203/2004 (H5N1). " On espère que les résultats de cette étude, combinés à d’autres qui devraient être achevés au printemps 2007, fourniront un vaccin hautement immunogène qui présente une protection croisée contre les souches hétérologues de la grippe.
Approbation et stockage du vaccin H5N1
Le 17 avril 2007, la première approbation américaine du vaccin contre la grippe H5N1 pour les humains a été donnée. Ce vaccin fabriqué par Sanofi-Aventis dans une usine de Swiftwater, en Pennsylvanie, ne doit pas être commercialisé; au lieu de cela, les États-Unis le stockent à titre de mesure provisoire pendant que de meilleurs vaccins sont recherchés. Deux injections administrées à 28 jours d'intervalle ont prouvé qu'elles protégeaient 45% des personnes ayant reçu le vaccin dans le cadre d'une étude. «Le ministère américain de la Santé et des Services sociaux a déclaré qu'il avait déjà acheté 13 millions de doses du vaccin Sanofi, suffisamment pour inoculer 6,5 millions de personnes. Le vaccin a été approuvé pour les personnes âgées de 18 à 64 ans. Des études dans d'autres groupes d'âge sont en cours. Le plus Les effets secondaires courants rapportés étaient des douleurs au site d'injection, des maux de tête, une sensation de malaise général et des douleurs musculaires, selon la FDA. "
Cette approbation du 17 avril 2007 par la Food and Drug Administration signifie que le vaccin n'est plus considéré comme expérimental et pourrait donc être administré pendant une pandémie sans que chaque receveur signe un formulaire donnant son consentement éclairé. [...] Les deux injections combinées contiennent 180 microgrammes d'antigène, le fragment du virus H5N1 conçu pour stimuler l'immunité. En revanche, un vaccin antigrippal conventionnel contient 45 microgrammes d'antigène: 15 microgrammes pour chacune des trois souches contre lesquelles il protège. "
Le vaccin approuvé le 17 avril 2007 "est basé sur un virus H5N1 isolé d'un patient vietnamien en 2004. L'approbation d'aujourd'hui par la FDA fait suite à une recommandation du 27 février d'un comité consultatif de la FDA, qui a conclu que le vaccin était sûr et efficace. Cependant , certains des membres du groupe ont émis des réserves quant à l'immunogénicité du vaccin, qui, dans les données soumises au groupe, était légèrement inférieure à ce qui avait été signalé précédemment dans un article de 2006 du New England Journal of Medicine. Dans un essai clinique, deux 90 microgrammes ( mcg) du vaccin, administré à 103 adultes en bonne santé à 28 jours d'intervalle, a généré une réponse immunitaire protectrice chez 45% des receveurs, a noté la FDA (les chercheurs ont utilisé un titre d'anticorps neutralisant de 1:40, soit une multiplication par quatre ou plus de titre d'anticorps, pour définir une réponse immunitaire adéquate.) [...] Le stock national contient actuellement 13 millions de doses du vaccin H5N1, assez pour vacciner 6,5 millions de personnes [...] HHS a déclaré qu'il allait de l'avant avec le dev mise au point d'un vaccin H5N1 "clade 2", basé sur des virus qui ont circulé chez les oiseaux en Chine et en Indonésie en 2003-04 et se sont propagés au Moyen-Orient, en Europe et en Afrique en 2005 et 2006. "
Médicaments antiviraux
De nombreux pays, ainsi que l’Organisation mondiale de la santé, s’emploient à stocker des médicaments antiviraux en vue d’une éventuelle pandémie. L'oseltamivir (nom commercial Tamiflu) est le médicament le plus recherché, car il est disponible sous forme de pilule. Le zanamivir (nom commercial Relenza) est également envisagé, mais il doit être inhalé. D'autres médicaments antiviraux sont moins susceptibles d'être efficaces contre la grippe pandémique.
Tamiflu et Relenza sont en pénurie et les capacités de production sont limitées à moyen terme. Certains médecins disent que la co-administration de Tamiflu avec le probénécide pourrait doubler les approvisionnements.
Il existe également le potentiel des virus à faire évoluer la résistance aux médicaments. Certaines personnes infectées par le H5N1 traitées par l'oseltamivir ont développé des souches résistantes de ce virus.
Le peramivir est un médicament pharmaceutique utilisé pour traiter les infections virales. Comme le zanamivir et l' oseltamivir , le peramivir est un inhibiteur de la neuraminidase , agissant en tant qu'inhibiteur analogue à l' état de transition de la neuraminidase de la grippe et empêchant ainsi de nouveaux virus d'émerger des cellules infectées. Les données expérimentales indiquent que le peramivir peut avoir une activité utile contre de nombreux virus d'intérêt, notamment le H5N1 (grippe aviaire), l' hépatite B , la polio , la rougeole et la variole . Le secrétaire du HHS, Mike Leavitt, a annoncé le 4 janvier 2007 que le ministère avait octroyé un contrat de 102,6 millions de dollars sur quatre ans à BioCryst Pharmaceuticals pour le développement avancé de leur médicament antiviral contre la grippe, le peramivir.
Plusieurs types de champignons ont été découverts in vitro pour avoir des propriétés antivirales contre le virus de la grippe, y compris le virus de la grippe de type A.
Recherche sur la grippe espagnole
Une hypothèse est que la souche virale est originaire de Fort Riley , Kansas , par deux mécanismes génétiques - dérive génétique et déplacement antigénique - de virus chez la volaille et les porcs que le fort a élevés pour la consommation locale. Mais les preuves d'une reconstruction récente du virus suggèrent qu'il est passé directement des oiseaux aux humains , sans se déplacer à travers les porcs. Le 5 octobre 2005, les chercheurs ont annoncé que la séquence génétique de la souche de grippe de 1918, un sous-type de la souche aviaire H1N1, avait été reconstruite à l'aide d'échantillons de tissus historiques. Le 18 janvier 2007, Kobasa et al. ont rapporté que les singes infectés ( Macaca fascicularis ) présentaient des symptômes classiques de la pandémie de 1918 et sont morts d'une tempête de cytokines .
Informatique distribuée
On peut partager du temps informatique pour des projets de recherche distribués faisant des recherches sur la grippe.
Folding @ Home , un programme informatique distribué de l'Université de Stanford , étudie la manière dont les virus traversent la membrane cellulaire (alors que la plupart des traitements se concentrent sur la prévention de la réplication virale ) et le rôle des protéines. Ils concentrent actuellement leurs recherches sur la grippe.
Rosetta @ Home travaille sur un inhibiteur de la grippe espagnole pour bloquer l'infection grippale.
Voir également
- Alliance mondiale pour les vaccins et la vaccination
- IFPMA Fédération internationale des associations de fabricants de produits pharmaceutiques
- Déclaration des cas de maladie
- Péché antigénique originel
- Centre d'évaluation et de recherche sur les produits biologiques
- ICEID
- Projet de séquençage du génome de la grippe
- Tempête de cytokines
- Partenariat international sur la grippe aviaire et pandémique
- Centres nationaux de la grippe
- Loi sur la préparation et l'intervention en cas de pandémie
Les références
Liens externes
- Base de données de recherche sur la grippe - Base de données des séquences génomiques de la grippe et des informations connexes.
- Portail Santé-UE Réponse de l'UE à la grippe

