Magnétochimie - Magnetochemistry
La magnétochimie s'intéresse aux propriétés magnétiques des composés chimiques . Les propriétés magnétiques proviennent du spin et du moment angulaire orbital des électrons contenus dans un composé. Les composés sont diamagnétiques lorsqu'ils ne contiennent pas d'électrons non appariés . Les composés moléculaires qui contiennent un ou plusieurs électrons non appariés sont paramagnétiques . L'amplitude du paramagnétisme est exprimée en moment magnétique effectif, μ eff . Pour les métaux de transition de première rangée , l'amplitude de eff est, en première approximation, une simple fonction du nombre d'électrons non appariés, la formule du spin seul. En général, le couplage spin-orbite fait que eff s'écarte de la formule de spin seul. Pour les métaux de transition plus lourds, les lanthanides et les actinides , le couplage spin-orbite ne peut être ignoré. L'interaction d'échange peut se produire dans des amas et des réseaux infinis, entraînant un ferromagnétisme , un antiferromagnétisme ou un ferrimagnétisme en fonction des orientations relatives des spins individuels.
Susceptibilité magnétique
La principale mesure en magnétochimie est la susceptibilité magnétique. Cela mesure la force de l'interaction en plaçant la substance dans un champ magnétique. La susceptibilité magnétique volumique , représentée par le symbole est définie par la relation
où, est l' aimantation du matériau (le moment dipolaire magnétique par unité de volume), mesurée en ampères par mètre ( unités SI ), et est l' intensité du champ magnétique , également mesurée en ampères par mètre. La susceptibilité est une quantité sans dimension . Pour les applications chimiques, la susceptibilité magnétique molaire (χ mol ) est la quantité préférée. Il est mesuré en m 3 ·mol -1 (SI) ou en cm 3 ·mol -1 (CGS) et est défini comme
où ρ est la masse volumique en kg.m -3 (SI) ou g.cm -3 (CGS) et M est la masse molaire en kg.mol -1 (SI) ou g.mol -1 (CGS).
Diverses méthodes sont disponibles pour la mesure de la susceptibilité magnétique.
- Avec la balance Gouy, la variation de poids de l'échantillon est mesurée avec une balance analytique lorsque l'échantillon est placé dans un champ magnétique homogène. Les mesures sont étalonnées par rapport à une norme connue, telle que le thiocyanate de mercure et de cobalt, HgCo(NCS) 4 . L'étalonnage élimine le besoin de connaître la densité de l'échantillon. Des mesures de température variable peuvent être effectuées en plaçant l'échantillon dans un cryostat entre les pièces polaires de l'aimant.
- La balance Evans . est une balance de torsion qui utilise un échantillon en position fixe et un aimant secondaire variable pour ramener les aimants dans leur position initiale. Il est également calibré par rapport au HgCo(NCS) 4 .
- Avec une balance Faraday, l'échantillon est placé dans un champ magnétique à gradient constant et pesé sur une balance de torsion. Cette méthode peut fournir des informations sur l'anisotropie magnétique .
- SQUID est un magnétomètre très sensible.
- Pour les substances en solution, la RMN peut être utilisée pour mesurer la sensibilité.
Types de comportement magnétique
Lorsqu'un atome isolé est placé dans un champ magnétique, il y a une interaction car chaque électron de l'atome se comporte comme un aimant, c'est-à-dire que l'électron a un moment magnétique . Il existe deux types d'interactions.
- Diamagnétisme. Lorsqu'il est placé dans un champ magnétique, l'atome devient magnétiquement polarisé, c'est-à-dire qu'il développe un moment magnétique induit. La force de l'interaction a tendance à pousser l'atome hors du champ magnétique. Par convention, la susceptibilité diamagnétique reçoit un signe négatif. Très souvent, les atomes diamagnétiques n'ont pas d'électrons non appariés, c'est-à-dire que chaque électron est apparié avec un autre électron dans la même orbitale atomique . Les moments des deux électrons s'annulent, de sorte que l'atome n'a pas de moment magnétique net. Cependant, pour l'ion Eu 3+ qui possède six électrons non appariés, le moment angulaire orbital annule le moment angulaire de l'électron, et cet ion est diamagnétique à zéro Kelvin.
- Paramagnétisme. Au moins un électron n'est pas apparié avec un autre. L'atome a un moment magnétique permanent. Lorsqu'il est placé dans un champ magnétique, l'atome est attiré dans le champ. Par convention, la susceptibilité paramagnétique reçoit un signe positif.
Lorsque l'atome est présent dans un composé chimique, son comportement magnétique est modifié par son environnement chimique. La mesure du moment magnétique peut donner des informations chimiques utiles.
Dans certains matériaux cristallins, les moments magnétiques individuels peuvent être alignés les uns avec les autres (le moment magnétique a à la fois une amplitude et une direction). Il en résulte un ferromagnétisme , un antiferromagnétisme ou un ferrimagnétisme . Ce sont des propriétés du cristal dans son ensemble, qui ont peu d'incidence sur les propriétés chimiques.
Diamagnétisme
Le diamagnétisme est une propriété universelle des composés chimiques, car tous les composés chimiques contiennent des paires d'électrons. Un composé dans lequel il n'y a pas d'électrons non appariés est dit diamagnétique. L'effet est faible car il dépend de l'amplitude du moment magnétique induit. Elle dépend du nombre de paires d'électrons et de la nature chimique des atomes auxquels elles appartiennent. Cela signifie que les effets sont additifs et qu'un tableau des "contributions diamagnétiques", ou constantes de Pascal , peut être constitué. Avec les composés paramagnétiques, la susceptibilité observée peut être ajustée en y ajoutant la correction dite diamagnétique, qui est la susceptibilité diamagnétique calculée avec les valeurs du tableau.
Paramagnétisme
Mécanisme et dépendance à la température
Un ion métallique avec un seul électron non apparié, tel que Cu 2+ , dans un complexe de coordination fournit l'illustration la plus simple du mécanisme du paramagnétisme. Les ions métalliques individuels sont éloignés les uns des autres par les ligands, de sorte qu'il n'y a pas d'interaction magnétique entre eux. Le système est dit magnétiquement dilué. Les dipôles magnétiques des atomes pointent dans des directions aléatoires. Lorsqu'un champ magnétique est appliqué, une division de Zeeman de premier ordre se produit. Les atomes avec des spins alignés sur le champ sont légèrement plus nombreux que les atomes avec des spins non alignés. Dans l'effet Zeeman de premier ordre, la différence d'énergie entre les deux états est proportionnelle à l'intensité du champ appliqué. En désignant la différence d'énergie sous la forme E , la distribution de Boltzmann donne le rapport des deux populations sous la forme , où k est la constante de Boltzmann et T la température en kelvins . Dans la plupart des cas, Δ E est beaucoup plus petit que kT et l'exponentielle peut être étendue comme 1 – Δ E/kT . Il résulte de la présence de 1/ T dans cette expression que la susceptibilité est inversement proportionnelle à la température.
Ceci est connu sous le nom de loi de Curie et la constante de proportionnalité, C , est connue sous le nom de constante de Curie , dont la valeur, pour la susceptibilité molaire, est calculée comme suit
où N est la constante d'Avogadro , g est le facteur g de Landé et B est le magnéton de Bohr . Dans ce traitement, il a été supposé que l' état fondamental électronique n'est pas dégénéré, que la susceptibilité magnétique n'est due qu'au spin des électrons et que seul l'état fondamental est thermiquement peuplé.
Alors que certaines substances obéissent à la loi de Curie, d'autres obéissent à la loi de Curie-Weiss .
T c est la température de Curie . La loi de Curie-Weiss ne s'appliquera que lorsque la température est bien au-dessus de la température de Curie. À des températures inférieures à la température de Curie, la substance peut devenir ferromagnétique . Un comportement plus compliqué est observé avec les éléments de transition plus lourds.
Moment magnétique efficace
Lorsque la loi de Curie est respectée, le produit de la susceptibilité molaire et de la température est une constante. Le moment magnétique effectif , eff est alors défini comme
Où C a des unités CGS cm 3 mol −1 K, eff est
Où C a des unités SI m 3 mol −1 K, eff est
La quantité μ eff est effectivement sans dimension, mais est souvent exprimée en unités de magnéton de Bohr (μ B ).
Pour les substances qui obéissent à la loi de Curie, le moment magnétique effectif est indépendant de la température. Pour d'autres substances, eff dépend de la température, mais la dépendance est faible si la loi de Curie-Weiss est vérifiée et que la température de Curie est faible.
Paramagnétisme indépendant de la température
Les composés qui sont censés être diamagnétiques peuvent présenter ce type de paramagnétisme faible. Il résulte d'un effet Zeeman de second ordre dans lequel une division supplémentaire, proportionnelle au carré de l'intensité du champ, se produit. Il est difficile à observer car le composé interagit également inévitablement avec le champ magnétique dans le sens diamagnétique. Néanmoins, des données sont disponibles pour l' ion permanganate . Il est plus facile à observer dans les composés des éléments les plus lourds, tels que les composés d' uranyle .
Échanger des interactions
Les interactions d'échange se produisent lorsque la substance n'est pas magnétiquement diluée et qu'il y a des interactions entre les centres magnétiques individuels. L'un des systèmes les plus simples à présenter le résultat d'interactions d'échange est l' acétate de cuivre (II) cristallin , Cu 2 (OAc) 4 (H 2 O) 2 . Comme l'indique la formule, il contient deux ions cuivre (II). Les ions Cu 2+ sont maintenus ensemble par quatre ligands acétate, dont chacun se lie aux deux ions cuivre. Chaque ion Cu 2+ a une configuration électronique ad 9 , et devrait donc avoir un électron non apparié. S'il y avait une liaison covalente entre les ions cuivre, les électrons s'apparieraient et le composé serait diamagnétique. Au lieu de cela, il y a une interaction d'échange dans laquelle les spins des électrons non appariés s'alignent partiellement les uns avec les autres. En fait deux états sont créés, l'un avec des spins parallèles et l'autre avec des spins opposés. La différence d'énergie entre les deux états est si petite que leurs populations varient considérablement avec la température. En conséquence, le moment magnétique varie avec la température selon un schéma sigmoïde . L'état avec des spins opposés a une énergie plus faible, donc l'interaction peut être classée comme antiferromagnétique dans ce cas. On pense qu'il s'agit d'un exemple de superéchange , médié par les atomes d'oxygène et de carbone des ligands acétate. D'autres dimères et clusters présentent un comportement d'échange.
Les interactions d'échange peuvent agir sur des chaînes infinies en une dimension, des plans en deux dimensions ou sur un cristal entier en trois dimensions. Ce sont des exemples d'ordre magnétique à longue portée. Ils donnent naissance au ferromagnétisme , à l' antiferromagnétisme ou au ferrimagnétisme , selon la nature et les orientations relatives des spins individuels.
Les composés à des températures inférieures à la température de Curie présentent un ordre magnétique à longue portée sous forme de ferromagnétisme. Une autre température critique est la température de Néel , en dessous de laquelle l'antiferromagnétisme se produit. L'hexahydrate de chlorure de nickel, NiCl 2 ·6H 2 O, a une température de Néel de 8,3 K. La susceptibilité est maximale à cette température. En dessous de la température de Néel la susceptibilité diminue et la substance devient antiferromagnétique.
Complexes d'ions de métaux de transition
Le moment magnétique effectif pour un composé contenant un ion de métal de transition avec un ou plusieurs électrons non appariés dépend du moment angulaire orbital et de spin total des électrons non appariés, et , respectivement. « Total » dans ce contexte signifie « somme vectorielle ». Dans l'approximation que les états électroniques des ions métalliques sont déterminés par le couplage Russell-Saunders et que le couplage spin-orbite est négligeable, le moment magnétique est donné par
Formule à essorer uniquement
Le moment angulaire orbital est généré lorsqu'un électron dans une orbitale d'un ensemble dégénéré d'orbitales est déplacé vers une autre orbitale de l'ensemble par rotation. Dans les complexes de faible symétrie, certaines rotations ne sont pas possibles. Dans ce cas, le moment angulaire orbital est dit "éteint" et est plus petit que ce à quoi on pourrait s'attendre (extinction partielle) ou nul (extinction complète). Il y a trempe complète dans les cas suivants. Notez qu'un électron dans une paire dégénérée d' orbitales d x 2 –y 2 ou d z 2 ne peut pas tourner dans l'autre orbitale à cause de la symétrie.
Moment angulaire orbital éteint d n octaédrique tétraédrique spin élevé faible rotation d 1 e 1 d 2 et 2 d 3 t 2g 3 j 4 t 2g 3 e g 1 d 5 t 2g 3 e g 2 d 6 t 2g 6 e 3 t 2 3 j 7 t 2g 6 e g 1 e 4 t 2 3 d 8 t 2g 6 e g 2 d 9 t 2g 6 e g 3
- légende : t 2g , t 2 = (d xy , d xz , d yz ). e g , e = (d x 2 –y 2 , d z 2 ).
Lorsque le moment angulaire orbital est complètement éteint et que le paramagnétisme peut être attribué au seul spin de l'électron. Le moment angulaire de spin total est simplement la moitié du nombre d'électrons non appariés et la formule de spin seul en résulte.
où n est le nombre d'électrons non appariés. La formule de spin seul est une bonne première approximation pour les complexes à spin élevé de métaux de transition de première rangée .
Ion Nombre d' électrons
non appariés
Moment de rotation seule /μ B
moment observé /μ BTi 3+ 1 1,73 1,73 V 4+ 1 1,73 1,68-1,78 Cu 2+ 1 1,73 1,70–2,20 V3 + 2 2,83 2,75-2,85 Ni 2+ 2 2,83 2,8–3,5 V2 + 3 3,87 3,80-3,90 Cr 3+ 3 3,87 3,70-3,90 Co 2+ 3 3,87 4.3–5.0 Mn 4+ 3 3,87 3,80–4,0 Cr 2+ 4 4,90 4.75-4.90 Fe 2+ 4 4,90 5.1–5.7 Mn 2+ 5 5,92 5.65–6.10 Fe 3+ 5 5,92 5.7–6.0
Les petits écarts par rapport à la formule du spin seul peuvent résulter de la négligence du moment angulaire orbital ou du couplage spin-orbite. Par exemple, les complexes tétraédriques d 3 , d 4 , d 8 et d 9 ont tendance à montrer des écarts plus importants par rapport à la formule de spin seul que les complexes octaédriques du même ion, car la « trempe » de la contribution orbitale est moins efficace dans le cas tétraédrique .
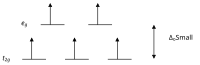
Complexes à faible spin
Selon la théorie du champ cristallin, les orbitales d d'un ion de métal de transition dans un complexe octaédal sont divisées en deux groupes dans un champ cristallin. Si la division est suffisamment importante pour surmonter l'énergie nécessaire pour placer les électrons dans la même orbitale, avec un spin opposé, un complexe à faible spin en résultera.
Complexes octaédriques à spin élevé et faible d-compte Nombre d'électrons non appariés exemples spin élevé faible rotation j 4 4 2 Cr 2+ , Mn 3+ d 5 5 1 Mn 2+ , Fe 3+ d 6 4 0 Fe 2+ , Co 3+ j 7 3 1 Co 2+
Avec un électron non apparié, les valeurs μ eff vont de 1,8 à 2,5 B et avec deux électrons non appariés, la plage est de 3,18 à 3,3 B . Notez que les complexes à faible spin de Fe 2+ et Co 3+ sont diamagnétiques. Un autre groupe de complexes qui sont diamagnétiques sont les complexes plans-carrés d' ions d 8 tels que Ni 2+ et Rh + et Au 3+ .
Croisement de rotation
Lorsque la différence d'énergie entre les états à haut spin et à bas spin est comparable à kT (k est la constante de Boltzmann et T la température) un équilibre s'établit entre les états de spin, faisant intervenir ce que l'on a appelé les « isomères électroniques ». Le tris- dithiocarbamato fer(III), Fe(S 2 CNR 2 ) 3 , est un exemple bien documenté. Le moment effectif varie d'une valeur de spin faible d 5 typique de 2,25 μ B à 80 K à plus de 4 μ B au-dessus de 300 K.
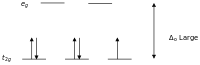
Métaux de transition de 2e et 3e rangées
La division du champ cristallin est plus importante pour les complexes des métaux de transition plus lourds que pour les métaux de transition décrits ci-dessus. Une conséquence de ceci est que les complexes à faible spin sont beaucoup plus fréquents. Les constantes de couplage spin-orbite, , sont également plus grandes et ne peuvent être ignorées, même dans les traitements élémentaires. Le comportement magnétique a été résumé, comme ci-dessous, avec un tableau complet de données.
d-compte kT / ζ = 0,1
μ effkT / ζ = 0
μ effComportement avec une grande constante de couplage spin-orbite, nd d 1 0,63 0 μ eff varie avec T 1/2 d 2 1,55 1.22 μ eff varie en fonction de T, environ d 3 3,88 3,88 Indépendant de la température j 4 2,64 0 μ eff varie avec T 1/2 d 5 1,95 1,73 μ eff varie en fonction de T, environ
Lanthanides et actinides
Le couplage Russell-Saunders, couplage LS, s'applique aux ions lanthanides, les effets du champ cristallin peuvent être ignorés, mais le couplage spin-orbite n'est pas négligeable. Par conséquent, les moments angulaires de spin et d'orbite doivent être combinés
et le moment magnétique calculé est donné par
Propriétés magnétiques des composés de lanthanides trivalents lanthanide Ce Pr Nd après-midi Sm UE Dieu To Dy Ho Euh Tm Yb Lu Nombre d'électrons non appariés 1 2 3 4 5 6 7 6 5 4 3 2 1 0 moment calculé /μ B 2,54 3.58 3.62 2,68 0,85 0 7,94 9,72 10,65 10.6 9,58 7.56 4,54 0 moment observé /μ B 2,3–2,5 3.4–3.6 3,5–3,6 1,4–1,7 3,3–3,5 7,9 à 8,0 9,5–9,8 10,4–10,6 10,4-10,7 9,4–9,6 7.1–7.5 4,3 à 4,9 0
Dans les actinides, le couplage spin-orbite est fort et le couplage se rapproche du couplage j j .
Cela signifie qu'il est difficile de calculer le moment effectif. Par exemple, l'uranium(IV), f 2 , dans le complexe [UCl 6 ] 2− a un moment effectif mesuré de 2,2 B , qui inclut une contribution du paramagnétisme indépendant de la température.
Éléments du groupe principal et composés organiques

Très peu de composés des éléments du groupe principal sont paramagnétiques. Des exemples notables incluent : oxygène , O 2 ; oxyde nitrique , NO; dioxyde d' azote , NO 2 et dioxyde de chlore , ClO 2 . En chimie organique , on dit que les composés avec un électron non apparié sont des radicaux libres . Les radicaux libres, à quelques exceptions près, sont de courte durée car un radical libre réagit rapidement avec un autre, de sorte que leurs propriétés magnétiques sont difficiles à étudier. Cependant, si les radicaux sont bien séparés les uns des autres en solution diluée dans une matrice solide, à basse température, ils peuvent être étudiés par résonance paramagnétique électronique (RPE). De tels radicaux sont générés par irradiation. Des études EPR approfondies ont révélé beaucoup de choses sur la délocalisation des électrons dans les radicaux libres. Le spectre simulé du radical CH 3 • montre une scission hyperfine due à l'interaction de l'électron avec les 3 noyaux d'hydrogène équivalents, chacun ayant un spin de 1/2.
Les marqueurs de spin sont des radicaux libres à longue durée de vie qui peuvent être insérés dans des molécules organiques afin qu'ils puissent être étudiés par EPR. Par exemple, le nitroxyde MTSL , un dérivé fonctionnalisé de l'oxyde de TEtra méthylpipéridine, TEMPO , est utilisé dans le marquage par spin dirigé .
Applications
L' ion gadolinium , Gd 3+ , a la configuration électronique f 7 , avec tous les spins parallèles. Les composés de l' ion Gd 3+ sont les plus appropriés pour être utilisés comme agent de contraste pour les IRM . Les moments magnétiques des composés de gadolinium sont plus grands que ceux de n'importe quel ion de métal de transition. Le gadolinium est préféré à d'autres ions lanthanides, dont certains ont des moments efficaces plus grands, en raison de son état fondamental électronique non dégénéré .
Pendant de nombreuses années, la nature de l' oxyhémoglobine , Hb-O 2 , était très controversée. Il s'est avéré expérimentalement diamagnétique. La désoxyhémoglobine est généralement considérée comme un complexe de fer à l'état d' oxydation +2 , c'est-à-dire un système ad 6 avec un moment magnétique à spin élevé proche de la valeur de spin seul de 4,9 B . Il a été proposé que le fer soit oxydé et l'oxygène réduit en superoxyde.
- Fe (II) Hb (spin élevé) + O 2 ⇌ [Fe (III) Hb] O 2 -
L'appariement des électrons de Fe 3+ et O 2 - a alors été proposé de se produire via un mécanisme d'échange. Il a maintenant été démontré qu'en fait, le fer (II) passe d'un spin élevé à un spin faible lorsqu'une molécule d'oxygène donne une paire d'électrons au fer. Alors que dans la désoxyhémoglobine, l'atome de fer se situe au-dessus du plan de l'hème, dans le complexe à faible spin, le rayon ionique effectif est réduit et l'atome de fer se trouve dans le plan de l'hème.
- Fe(II)Hb + O 2 [Fe(II)Hb]O 2 (faible spin)
Cette information a une incidence importante sur la recherche pour trouver des transporteurs d'oxygène artificiels .
Les composés du gallium(II) étaient inconnus jusqu'à tout récemment. Comme le numéro atomique du gallium est un nombre impair (31), Ga 2+ devrait avoir un électron non apparié. On supposait qu'il agirait comme un radical libre et aurait une durée de vie très courte. La non-existence des composés Ga(II) faisait partie de ce qu'on appelle l' effet de paire inerte . Lorsque des sels de l'anion de formule empirique telle que [GaCl 3 ] − ont été synthétisés, ils se sont avérés diamagnétiques. Cela impliquait la formation d'une liaison Ga-Ga et d'une formule dimère, [Ga 2 Cl 6 ] 2− .
Voir également
- Minéralogie magnétique
- Magnétoélectrochimie
- Liquide ionique magnétique
- Faire tourner la glace
- Tourner le verre
- Superdiamagnetism , superparamagnétisme , Superferromagnetism
- Magnétisme à molécule unique
Les références
Bibliographie
- Carlin, RL (1986). Magnétochimie . Springer . ISBN 978-3-540-15816-5.
- Earnshaw, Alan (1968). Introduction à la magnétochimie . Presse Académique .
- Figgis, BN; Lewis, J. (1960). « La magnétochimie des composés complexes ». Dans Lewis. J. et Wilkins. RG (éd.). Chimie de coordination moderne . New York : Wiley .
- Greenwood, Norman N. ; Earnshaw, Alan (1997). Chimie des éléments (2e éd.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- Verger, AF (2003). Magnétochimie . Primaires de chimie d'Oxford. Presse de l'Université d'Oxford . ISBN 0-19-879278-6.
- Selwood, PW (1943). Magnétochimie . Éditeurs Interscience Inc.
- Vulfson, Sergueï (1998). Magnétochimie moléculaire . Taylor & François . ISBN 90-5699-535-9.