Transglutaminase tissulaire - Tissue transglutaminase
| Protéine-glutamine gamma-glutamyltransférase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifiants | |||||||||
| CE n° | 2.3.2.13 | ||||||||
| N ° CAS. | 80146-85-6 | ||||||||
| Bases de données | |||||||||
| IntEnz | Vue IntEnz | ||||||||
| BRENDA | Entrée BRENDA | ||||||||
| ExPASy | Vue NiceZyme | ||||||||
| KEGG | Entrée KEGG | ||||||||
| MétaCycle | voie métabolique | ||||||||
| PRIAM | profil | ||||||||
| Structures de l' APB | RCSB PDB PDBe PDBsum | ||||||||
| Ontologie des gènes | AmiGO / QuickGO | ||||||||
| |||||||||
La transglutaminase tissulaire (en abrégé tTG ou TG2 ) est une enzyme calcium-dépendante de 78 kDa ( EC 2.3.2.13 ) de la famille des protéines-glutamine γ-glutamyltransférases (ou simplement de la famille des transglutaminases ). Comme les autres transglutaminases, elle réticule les protéines entre un groupe -amino d'un résidu lysine et un groupe γ- carboxamide du résidu glutamine , créant une liaison inter- ou intramoléculaire très résistante à la protéolyse (dégradation des protéines). Outre sa fonction de réticulation, la tTG catalyse d'autres types de réactions, notamment la désamidation , la liaison/hydrolyse du GTP et les activités d'isopeptidase. Contrairement à d'autres membres de la famille des transglutaminases, la tTG peut être trouvée à la fois dans les espaces intracellulaires et extracellulaires de divers types de tissus et se trouve dans de nombreux organes différents, notamment le cœur, le foie et l'intestin grêle. La tTG intracellulaire est abondante dans le cytosol mais des quantités plus faibles peuvent également être trouvées dans le noyau et les mitochondries . On pense que la tTG intracellulaire joue un rôle important dans l' apoptose . Dans l'espace extracellulaire, la tTG se lie aux protéines de la matrice extracellulaire (ECM), se liant particulièrement étroitement à la fibronectine . La tTG extracellulaire a été liée à l'adhésion cellulaire, à la stabilisation de la MEC, à la cicatrisation des plaies, à la signalisation des récepteurs, à la prolifération cellulaire et à la motilité cellulaire.
Le tTG est l' auto - antigène de la maladie cœliaque , une maladie chronique dans laquelle la consommation de gluten alimentaire provoque une réponse immunitaire pathologique entraînant une inflammation de l'intestin grêle et une atrophie villositaire subséquente . Il a également été impliqué dans la physiopathologie de nombreuses autres maladies, notamment de nombreux cancers et maladies neurogénératives.
Structure
Gène
Le gène tTG humain est situé sur le 20e chromosome (20q11.2-q12).
Protéine
La TG2 est une enzyme multifonctionnelle appartenant aux transglutaminases qui catalysent la réticulation des protéines par des liaisons isopeptidiques epsilon-(gamma-glutamyl)lysine. À l'instar des autres transglutaminases, la tTG se compose d'un site de liaison GTP/GPD, d'un domaine catalytique , de deux bêta-tonneaux et d'un bêta-sandwich . Les structures cristallines de TG2 avec GDP , GTP ou ATP lié ont démontré que ces formes de TG2 adoptent une conformation "fermée", tandis que TG2 avec le site actif occupé par un imitateur de peptide de gluten inhibiteur ou d'autres inhibiteurs similaires adopte une conformation "ouverte". Dans la conformation ouverte, les quatre domaines de TG2 sont disposés dans une configuration étendue, permettant une activité catalytique, tandis que dans la conformation fermée, les deux domaines C-terminaux sont repliés sur le domaine central catalytique qui comprend le résidu Cys-277. Le domaine N-terminal ne montre que des changements structurels mineurs entre les deux conformations différentes.
Mécanisme
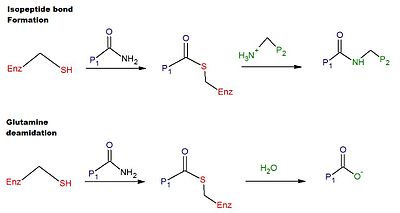
Le mécanisme catalytique de réticulation dans la tTG humaine implique le groupe thiol d'un résidu Cys dans le site actif de la tTG. Le groupe thiol attaque le carboxamide d'un résidu glutamine à la surface d'un substrat protéique ou peptidique, libérant de l' ammoniac et produisant un intermédiaire thioester . L'intermédiaire thioester peut alors être attaqué par l'amine de surface d'un second substrat (typiquement à partir d'un résidu lysine ). Le produit final de la réaction est une liaison isopeptidique stable entre les deux substrats (c'est-à-dire une réticulation). En variante, l'intermédiaire thioester peut être hydrolyse, entraînant la conversion nette du résidu glutamine en acide glutamique (c'est-à-dire désamidation). La désamidation des résidus de glutamine catalysée par la tTG serait liée à la réponse immunitaire pathologique au gluten dans la maladie cœliaque. Un schéma des réactions de réticulation et de désamidation est présenté sur la figure 1.
Régulation
L'expression de la tTG est régulée au niveau transcriptionnel en fonction de cascades de signaux complexes . Une fois synthétisée, la majeure partie de la protéine se trouve dans le cytoplasme, la membrane plasmique et la MEC, mais une petite fraction est transloquée vers le noyau , où elle participe au contrôle de sa propre expression via la régulation des facteurs de transcription .
L'activité de réticulation par tTG nécessite la liaison des ions Ca 2+ . Plusieurs Ca 2+ peuvent se lier à une seule molécule de tTG. Plus précisément, la tTG se lie jusqu'à 6 ions calcium sur 5 sites de liaison différents. Des mutations de ces sites de liaison provoquant une affinité calcique inférieure, diminuent l'activité transglutaminase de l'enzyme. En revanche, la liaison d'une molécule de GTP ou GDP inhibe l'activité de réticulation de l'enzyme. Par conséquent, la tTG intracellulaire est principalement inactive en raison de la concentration relativement élevée de GTP/GDP et des faibles niveaux de calcium à l'intérieur de la cellule. Bien que la tTG extracellulaire soit censée être active en raison de la faible concentration de nucléotides de guanine et des niveaux élevés de calcium dans l'espace extracellulaire, des preuves ont montré que la tTG extracellulaire est principalement inactive. Des études récentes suggèrent que la tTG extracellulaire est maintenue inactive par la formation d'une liaison disulfure entre deux résidus cystéine vicinaux , à savoir Cys 370 et Cys 371. Lorsque cette liaison disulfure se forme, l'enzyme reste dans une confirmation ouverte mais devient catalytiquement inactive. L'oxydation/réduction de la liaison disulfure sert de troisième mécanisme de régulation allostérique (avec GTP/GDP et Ca 2+ ) pour l'activation de tTG. Il a été démontré que la thiorédoxine -1 active la tTG extracellulaire en réduisant la liaison disulfure. Une autre liaison disuplhide peut se former dans tTG, entre les résidus Cys-230 et Cys-370. Bien que cette liaison n'existe pas à l'état natif de l'enzyme, elle apparaît lorsque l'enzyme est inactivée par oxydation. La présence de calcium protège contre la formation des deux liaisons disulfure, rendant ainsi l'enzyme plus résistante à l'oxydation.
Des études récentes ont suggéré que l'interféron-γ pourrait servir d'activateur de la tTG extracellulaire dans l'intestin grêle ; ces études ont une implication directe dans la pathogenèse de la maladie cœliaque. Il a été démontré que l'activation de la tTG s'accompagnait de grands changements conformationnels, passant d'une conformation compacte (inactive) à une conformation étendue (active). (voir illustration 3)
Dans la matrice extracellulaire , la TG2 est « désactivée », principalement en raison de l'activité oxydante de la protéine du réticulum endoplasmique 57 (ERp57). Ainsi, la tTG est allostériquement régulée par deux protéines distinctes, Erp57 et TRX-1. (Voir Figure 4).
Fonction
La tTG est exprimée de manière ubiquitaire et est présente dans divers compartiments cellulaires, tels que le cytosol, le noyau et la membrane plasmique. Il nécessite du calcium comme cofacteur pour l'activité de transamidation. La transcription est augmentée par l'acide rétinoïque . Parmi ses nombreuses fonctions supposées, il semble jouer un rôle dans la cicatrisation , l' apoptose et le développement de la matrice extracellulaire ainsi que dans la différenciation et l'adhésion cellulaire . Il a été noté que la tTG peut avoir une activité très différente dans différents types cellulaires. Par exemple, dans les neurones , la tTG soutient la survie des cellules soumises à des lésions alors que dans les astrocytes, l' inactivation de l'expression du gène de la tTG est bénéfique pour la survie des cellules.
On pense que la tTG est impliquée dans la régulation du cytosquelette en réticulant diverses protéines du cytosquelette, notamment la myosine, l'actine et la spectrine . Les preuves montrent que la tTG intracellulaire se réticule à la myosine. On pense également que la tTG peut stabiliser la structure des cellules mourantes pendant l'apoptose en polymérisant les composants du cytosquelette, empêchant ainsi la fuite du contenu cellulaire dans l'espace extracellulaire.
La tTG possède également une activité GTPase : en présence de GTP, elle suggère de fonctionner comme une protéine G participant aux processus de signalisation. Outre son activité transglutaminase, il est proposé que la tTG agisse également en tant que kinase, protéine disulfure isomérase et désamidase. Cette dernière activité est importante dans la désamidation des peptides de gliadine, jouant ainsi un rôle important dans la pathologie de la maladie cœliaque .
tTG présente également une activité PDI (Protein Disulfide Isomerase). Sur la base de son activité PDI, la tTG joue un rôle important dans la régulation de la protéostase , en catalysant la trimérisation de HSF1 (Heat Shock Factor 1) et donc la réponse de l'organisme au choc thermique. En l'absence de tTG, la réponse au choc thermique est altérée car le trimère nécessaire n'est pas formé.
Signification clinique
La tTG est la transglutaminase la plus étudiée et a été associée à de nombreuses maladies. Cependant, aucune de ces maladies n'est liée à un déficit enzymatique. En effet, jusqu'à présent, aucune maladie n'a été attribuée au manque d'activité de tTG et cela a été attesté par l'étude de souris knock-out pour tTG.
Maladie coeliaque
La tTG est surtout connue pour son lien avec la maladie cœliaque . Il a été associé pour la première fois à la maladie cœliaque en 1997 lorsque l'enzyme s'est avérée être l'antigène reconnu par les anticorps spécifiques de la maladie cœliaque. Les anticorps anti-transglutaminase entraînent une forme de sensibilité du gluten dans lequel une réponse cellulaire à hordées glutens réticulés à TTG sont capables de stimuler spécifiques transglutaminase cellules B réponses qui aboutissent finalement à la production d'anticorps anti-transglutaminase anticorps IgA et IgG. tTG désamide spécifiquement les résidus de glutamine créant des épitopes qui augmentent l'affinité de liaison du peptide de gluten aux cellules T présentant l'antigène , initiant une réponse immunitaire adaptative.
Cancer
Des études récentes suggèrent que la tTG joue également un rôle dans l' inflammation et la biologie tumorale. L'expression de la tTG est élevée dans plusieurs types de cellules cancéreuses et est impliquée dans la résistance aux médicaments et les métastases en raison de sa capacité à favoriser la transition mésenchymateuse et les propriétés de type cellule souche. Sous sa forme liée au GTP, la tTG contribue à la survie des cellules cancéreuses et semble être un moteur du cancer. tTG est régulée positivement dans les cellules cancéreuses et les tissus dans de nombreux types de cancer, y compris la leucémie , le cancer du sein , le cancer de la prostate , le cancer du pancréas et le cancer du col utérin . Une expression plus élevée de tTG est également en corrélation avec des cas plus élevés de métastases , une résistance à la chimiothérapie , des taux de survie plus faibles et un pronostic généralement sombre. Les cellules cancéreuses peuvent être tuées en augmentant les niveaux de calcium par l'activation de l'activité de transamidation tTG. Les essais précliniques se sont révélés prometteurs dans l'utilisation des inhibiteurs de la tTG comme agents thérapeutiques anticancéreux. Cependant, d'autres études ont noté que l'activité de transamidation de la tTG pourrait être liée à l'inhibition de l'invasivité des cellules tumorales.
Autres maladies
On pense que la tTG contribue à plusieurs troubles neurodégénératifs, notamment les maladies d'Alzheimer , de Parkinson et de Huntington , en affectant la transcription, la différenciation, la migration et l'adhésion. De telles maladies neurologiques sont caractérisées en partie par l'agrégation anormale de protéines due à l'augmentation de l'activité de réticulation des protéines dans le cerveau affecté. De plus, des protéines spécifiques associées à ces troubles se sont avérées être des substrats in vivo et in vitro de la tTG. Bien que la tTG soit régulée à la hausse dans les zones du cerveau touchées par la maladie de Huntington, une étude récente a montré que l'augmentation des niveaux de tTG n'affecte pas l'apparition et/ou la progression de la maladie chez la souris. Des études récentes montrent que la tTG peut ne pas être impliquée dans la MA, car des études montrent qu'elle est associée à la lyse des érythrocytes et qu'elle est une conséquence de la maladie plutôt qu'une cause.
La tTG a également été liée à la pathogenèse de la fibrose dans divers organes, dont le poumon et le rein . Plus précisément, dans la fibrose rénale, la tTG contribue à la stabilisation et à l'accumulation de la MEC affectant l' activité bêta du TGF .
Diagnostique
La sérologie pour les anticorps anti-tTG a remplacé les tests sérologiques plus anciens (anti-endomysium, anti-gliadine et anti-réticuline) et a une forte sensibilité (99 %) et spécificité (> 90 %) pour identifier la maladie cœliaque. Les tests anti-tTG modernes reposent sur une protéine recombinante humaine comme antigène.
Thérapeutique
Il est encore expérimental d'utiliser le tTG comme forme de colle chirurgicale. Il est également à l'étude comme atténuateur de métastases dans certaines tumeurs. tTG est prometteur en tant que cible thérapeutique potentielle pour traiter la fibrose cardiaque , par l'activité d'un tTG très sélectif inhibiteur . Il a également été démontré que les inhibiteurs de tTG inhibent la formation d'inclusions toxiques liées aux maladies neurodégénératives . Cela indique que les inhibiteurs de tTG pourraient également servir d'outil pour atténuer la progression des maladies liées au cerveau tTG.
Interactions
TG2 participe à la fois aux interactions enzymatiques et non enzymatiques . Des interactions enzymatiques se forment entre TG2 et ses protéines substrats contenant les groupements donneur de glutamine et donneur de lysine en présence de calcium . Les substrats de TG2 sont connus pour affecter l'activité de TG2, ce qui lui permet par la suite d'exécuter diverses fonctions biologiques dans la cellule. Cependant, l'importance des interactions non enzymatiques dans la régulation des activités de TG2 n'a pas encore été révélée. Des études récentes indiquent que les interactions non enzymatiques jouent des rôles physiologiques et permettent diverses fonctions TG2 d'une manière spécifique au contexte.
| Allèles mutants de souris pour Tgm2 | |
|---|---|
| Symbole de marqueur pour le gène de la souris. Ce symbole est attribué au locus génomique par le MGI | Tgm2 |
| Clones de cellules souches embryonnaires de souris mutantes. Ce sont les mutations ciblées connues pour ce gène chez une souris. | Tgm2 tm1a(KOMP)Wtsi |
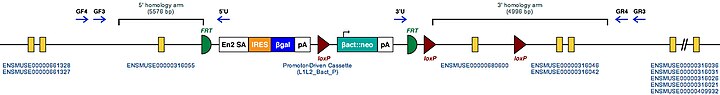
| Exemple de structure d'allèle mutant conditionnel ciblé pour ce gène | |
|
|
| Ces cellules ES mutantes peuvent être étudiées directement ou utilisées pour générer des souris avec ce gène inactivé. L'étude de ces souris peut éclairer la fonction de Tgm2 : voir Knockout mouse | |
Les références
Liens externes
- Anticorps endomysiaux
- Une collection de substrats et de partenaires d'interaction de TG2 est accessible dans TRANSDAB , une base de données interactive de substrats de transglutaminase.