Acétylation et désacétylation des histones - Histone acetylation and deacetylation
L'acétylation et la désacétylation des histones sont les processus par lesquels les résidus de lysine dans la queue N-terminale dépassant du noyau des histones du nucléosome sont acétylés et désacétylés dans le cadre de la régulation des gènes .
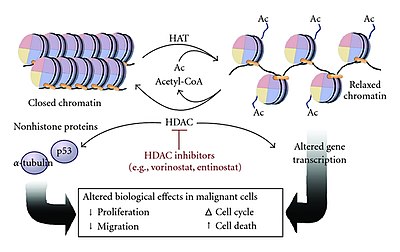
L'acétylation et la désacétylation des histones sont des éléments essentiels de la régulation des gènes . Ces réactions sont typiquement catalysées par des enzymes ayant une activité « histone acétyltransférase » (HAT) ou « histone désacétylase » (HDAC). L'acétylation est le processus par lequel un groupe fonctionnel acétyle est transféré d'une molécule (dans ce cas, l' acétyl coenzyme A ) à une autre. La désacétylation est simplement la réaction inverse où un groupe acétyle est retiré d'une molécule.
Les histones acétylées, des protéines octamériques qui organisent la chromatine en nucléosomes , unité structurelle de base des chromosomes et finalement en structures d'ordre supérieur, représentent un type de marqueur épigénétique au sein de la chromatine . L'acétylation supprime la charge positive sur les histones, diminuant ainsi l'interaction des terminaisons N des histones avec les groupes phosphate de l' ADN chargés négativement . En conséquence, la chromatine condensée est transformée en une structure plus détendue qui est associée à des niveaux plus élevés de transcription génique . Cette relaxation peut être inversée par désacétylation catalysée par l'activité HDAC. L'ADN relaxé et transcriptionnellement actif est appelé euchromatine . L'ADN plus condensé (très compact) est appelé hétérochromatine . La condensation peut être provoquée par des processus comprenant la désacétylation et la méthylation.
Mécanisme d'action
Les nucléosomes sont des portions d' ADN double brin (ADNdb) qui sont enroulées autour de complexes protéiques appelés noyaux d'histones. Ces noyaux d'histones sont composés de 8 sous-unités, deux chacune d' histones H2A , H2B , H3 et H4 . Ce complexe protéique forme une forme cylindrique que l'ADNdb entoure avec environ 147 paires de bases. Les nucléosomes sont formés comme une étape de départ pour le compactage de l'ADN qui contribue également au soutien structurel ainsi qu'à des rôles fonctionnels. Ces rôles fonctionnels sont contribués par les queues des sous-unités d'histone. Les queues d'histone s'insèrent dans les petits sillons de l'ADN et s'étendent à travers la double hélice, ce qui les laisse ouvertes aux modifications impliquées dans l'activation transcriptionnelle. L'acétylation a été étroitement associée à des augmentations de l'activation transcriptionnelle, tandis que la désacétylation a été liée à la désactivation transcriptionnelle. Ces réactions surviennent après la traduction et sont réversibles.
Le mécanisme d'acétylation et de désacétylation a lieu sur les groupes NH3+ des résidus d'acides aminés de la lysine. Ces résidus sont situés sur les queues des histones qui constituent le nucléosome de l'ADNdb emballé. Le processus est facilité par des facteurs connus sous le nom d' histone acétyltransférases (HAT). Les molécules HAT facilitent le transfert d'un groupe acétyle d'une molécule d' acétyl-coenzyme A (acétyl-CoA) au groupe NH3+ sur la lysine. Lorsqu'une lysine doit être désacétylée, des facteurs connus sous le nom d' histone désacétylases (HDAC) catalysent l'élimination du groupe acétyle avec une molécule de H2O.
L'acétylation a pour effet de changer la charge globale de la queue d'histone de positive à neutre. La formation des nucléosomes dépend des charges positives des histones H4 et de la charge négative à la surface des domaines de repliement des histones H2A. L'acétylation des queues d'histone perturbe cette association, conduisant à une liaison plus faible des composants nucléosomiques. En faisant cela, l'ADN est plus accessible et conduit à davantage de facteurs de transcription pouvant atteindre l'ADN. Ainsi, l'acétylation des histones est connue pour augmenter l'expression des gènes par l'activation de la transcription. La désacétylation effectuée par les molécules HDAC a l'effet inverse. En désacétylant les queues d'histone, l'ADN devient plus étroitement enroulé autour des noyaux d'histone, ce qui rend plus difficile la liaison des facteurs de transcription à l'ADN. Cela conduit à une diminution des niveaux d'expression des gènes et est connu sous le nom de silençage génique.
Les histones acétylées, les noyaux protéiques octomériques des nucléosomes, représentent un type de marqueur épigénétique au sein de la chromatine. Des études ont montré qu'une modification a tendance à influencer si une autre modification aura lieu. Les modifications des histones peuvent non seulement provoquer des changements structurels secondaires à leurs points spécifiques, mais peuvent également provoquer de nombreux changements structurels dans des endroits éloignés, ce qui affecte inévitablement la fonction. Au fur et à mesure que le chromosome est répliqué, les modifications qui existent sur les chromosomes parentaux sont transmises aux chromosomes filles. Les modifications, dans le cadre de leur fonction, peuvent recruter des enzymes pour leur fonction particulière et peuvent contribuer à la poursuite des modifications et de leurs effets après la réplication. Il a été démontré que, même après une réplication, l'expression des gènes peut encore être affectée de nombreuses générations cellulaires plus tard. Une étude a montré que, lors de l'inhibition des enzymes HDAC par la trichostatine A, les gènes insérés à côté de l'hétérochromatine centrée montraient une expression accrue. De nombreuses générations cellulaires plus tard, en l'absence de l'inhibiteur, l'expression génique accrue était toujours exprimée, montrant que des modifications peuvent être effectuées par de nombreux processus de réplication tels que la mitose et la méiose.
Enzymes d'acétylation/désacétylation des histones
Histone acétyltransférase (HAT)
Les histones acétyltransférases, également appelées HAT, sont une famille d'enzymes qui acétylent les queues d'histone du nucléosome. Ceci, et d'autres modifications, sont exprimés sur la base des différents états de l'environnement cellulaire. De nombreuses protéines ayant des capacités d'acétylation ont été documentées et, après un certain temps, ont été classées en fonction des similitudes de séquence entre elles. Ces similitudes sont élevées parmi les membres d'une famille, mais les membres de différentes familles présentent très peu de ressemblance. Certaines des grandes familles identifiées à ce jour sont les suivantes.
Famille GNAT
Les N-acétyltransférases (GNAT) apparentées au contrôle général 5 (Gcn5) sont l'une des nombreuses familles étudiées ayant des capacités d'acétylation. Cette superfamille comprend les facteurs Gcn5 qui sont inclus dans les complexes SAGA, SLIK, STAGA, ADA et A2, Gcn5L, le facteur associé à la protéine de liaison p300/CREB (PCAF) , Elp3 , HPA2 et HAT1 . Les principales caractéristiques de la famille GNAT comprennent des domaines HAT d'une longueur d'environ 160 résidus et un bromodomaine conservé qui s'est avéré être un motif de ciblage de l'acétyl-lysine. Il a été démontré que Gcn5 acétyle les substrats lorsqu'il fait partie d'un complexe. Le Gcn5 recombinant s'est avéré impliqué dans l'acétylation des histones H3 du nucléosome. Dans une moindre mesure, il s'est avéré qu'il acétyle également les histones H2B et H4 lorsqu'il est impliqué avec d'autres complexes. Le PCAF a la capacité d'agir comme une protéine HAT et d'acétyler des histones, il peut acétyler des protéines non histones liées à la transcription, ainsi qu'agir comme coactivateur dans de nombreux processus, notamment la myogenèse , l' activation à médiation par les récepteurs nucléaires et le facteur de croissance signalé. Activation. Elp3 a la capacité d'acétyler toutes les sous-unités d'histone et montre également une implication dans l' holoenzyme ARN polymérase II .
famille MYST
MOZ (Monocytic Leukemia Zinc Finger Protein), Ybf2/Sas3, Sas2 et Tip60 (Tat Interacting Protein) constituent tous MYST, une autre famille bien connue qui présente des capacités d'acétylation. Cette famille comprend Sas3, l'acétyltransférase essentielle liée au SAS (Esa1), Sas2, Tip60, MOF, MOZ, MORF et HBO1. Les membres de cette famille ont de multiples fonctions, non seulement avec l'activation et le silence des gènes, mais affectent également le développement et ont des implications dans les maladies humaines. Sas2 et Sas3 sont impliqués dans l'extinction de la transcription, MOZ et TIF2 sont impliqués dans la formation de produits de transclocation leucémique tandis que MOF est impliqué dans la compensation de dose chez la drosophile . Le MOF influence également la spermatogenèse chez la souris car il est impliqué dans l'expansion de la phosphorylation de H2AX au cours des stades leptotène à pachytène de la méiose . Les domaines HAT pour cette famille sont d'environ 250 résidus qui comprennent des domaines de liaison au zinc riches en cysteine ainsi que des chromodomaines N-terminaux. Les protéines MYST Esa1, Sas2 et Sas3 se trouvent dans la levure, MOF se trouve chez la drosophile et les souris tandis que Tip60, MOZ, MORF et HBO1 se trouvent chez l'homme. Tip60 joue un rôle dans la régulation de la transcription des gènes, HBO a un impact sur le processus de réplication de l'ADN, MORF est capable d'acétyler les histones libres (en particulier H3 et H4) ainsi que les histones nucléosomiques.
Famille p300/CBP
La protéine adénovirale associée à E1A de 300 kDa (p300) et la protéine de liaison CREB (CBP) constituent la prochaine famille de THA. Cette famille de HAT contient des domaines HAT longs d'environ 500 résidus et contenant des bromodomaines ainsi que trois domaines riches en cystéine-histidine qui facilitent les interactions protéiques. Ces HAT sont connues pour acétyler toutes les sous-unités d'histone dans le nucléosome. Ils ont également la capacité d'acétyler et de médier des protéines non histones impliquées dans la transcription et sont également impliquées dans le cycle cellulaire , la différenciation et l' apoptose .
Autres HAT
Il existe d'autres protéines qui ont des capacités d'acétylation mais diffèrent par leur structure des familles mentionnées précédemment. Un HAT est appelé steroid receptor coactivateur 1 (SRC1) , qui a un domaine HAT situé à l'extrémité C-terminale de la protéine avec une hélice de base-boucle-hélice et des domaines PAS A et PAS B avec un motif d'interaction avec le récepteur LXXLL dans le milieu. Un autre est l'ATF-2 qui contient un domaine d' activation transcriptionnelle (ACT) et un domaine de liaison à l'ADN à glissière basique (bZip) avec un domaine HAT entre les deux. Le dernier est TAFII250 qui a un domaine Kinase dans la région N-terminale, deux bromodomaines situés dans la région C-terminale et un domaine HAT situé entre les deux.
Histone désacétylase (HDAC)
Il existe un total de quatre classes qui catégorisent les histones désacétylases (HDAC). La classe I comprend les HDAC 1 , 2 , 3 et 8 . La classe II est divisée en deux sous-groupes, la classe IIA et la classe IIB. La classe IIA comprend les HDAC 4 , 5 , 7 et 9 , tandis que la classe IIB comprend les HDAC 6 et 10 . La classe III contient les sirtuines et la classe IV ne contient que HDAC11 . Les classes de protéines HDAC sont divisées et regroupées sur la base de la comparaison avec les homologies de séquences de Rpd3, Hos1 et Hos2 pour les HDAC de classe I, HDA1 et Hos3 pour les HDAC de classe II et les sirtuines pour les HDAC de classe III.
HDAC de classe I
HDAC1 et HDAC2
HDAC1 et HDAC2 appartiennent à la première classe des HDAC les plus étroitement liés les uns aux autres. En analysant les séquences globales des deux HDAC, leur similitude s'est avérée être homologue à environ 82 %. Ces enzymes se sont révélées inactives lorsqu'elles sont isolées, ce qui a conduit à la conclusion qu'elles doivent être incorporées avec des cofacteurs afin d'activer leurs capacités de désacétylase. Il existe trois principaux complexes protéiques dans lesquels HDAC 1 et 2 peuvent s'incorporer. Ces complexes comprennent Sin3 (du nom de sa protéine caractéristique mSin3A ), le complexe de remodelage et de désacétylation des nucléosomes (NuRD) et Co-REST . Le complexe Sin3 et le complexe NuRD contiennent tous deux les HDAC 1 et 2, la protéine associée à Rb 48 (RbAp48) et RbAp46 qui constituent le cœur de chaque complexe. Cependant, d'autres complexes peuvent être nécessaires afin d'initier la quantité maximale d'activité disponible possible. Les HDAC 1 et 2 peuvent également se lier directement aux protéines de liaison à l'ADN telles que Yin et Yang 1 (YY1) , la protéine de liaison Rb 1 et Sp1 . Les HDAC 1 et 2 se sont avérés exprimer des rôles régulateurs dans des gènes clés du cycle cellulaire, y compris p21 .
L'activité de ces HDAC peut être affectée par la phosphorylation . Une quantité accrue de phosphorylation ( hyperphosphorylation ) entraîne une augmentation de l'activité de la désacétylase, mais dégrade la formation de complexes entre les HDAC 1 et 2 et entre HDAC1 et mSin3A/YY1. Une quantité inférieure à la normale de phosphorylation (hypophosphorylation) entraîne une diminution de la quantité d'activité de la désacétylase, mais augmente la quantité de formation de complexes. Des études de mutation ont montré qu'une phosphorylation majeure se produit au niveau des résidus Ser 421 et Ser 423 . En effet, lorsque ces résidus ont été mutés, une réduction drastique a été observée dans la quantité d'activité de désacétylation. Cette différence d'état de phosphorylation est un moyen de maintenir un niveau optimal de phosphorylation pour s'assurer qu'il n'y a pas de sur ou sous expression de désacétylation. Les HDAC 1 et 2 n'ont été trouvés qu'exclusivement dans le noyau . Chez les souris HDAC1 knock-out (KO) , les souris mouraient au cours de l' embryogenèse et présentaient une réduction drastique de la production mais une expression accrue des inhibiteurs de la kinase cycline-dépendante (CDKI) p21 et p27 . Même une régulation à la hausse des autres HDAC de classe I ne pourrait pas compenser la perte de HDAC1. Cette incapacité à se remettre de HDAC1 KO conduit les chercheurs à croire qu'il ya à la fois fonctionnelle unique à chaque HDAC ainsi que la réglementation diaphonie entre les facteurs.
HDAC3
HDAC3 s'est avéré être le plus étroitement lié à HDAC8. HDAC3 contient une région non conservée dans la région C-terminale qui s'est avérée nécessaire pour la répression transcriptionnelle ainsi que son activité désacétylase. Il contient également deux régions, l'une appelée signal de localisation nucléaire (NLS) ainsi qu'un signal d'exportation nucléaire (NES) . Le NLS fonctionne comme un signal d'action nucléaire tandis qu'un NES fonctionne avec des HDAC qui effectuent des travaux en dehors du noyau. La présence des deux signaux pour HDAC3 suggère qu'il se déplace entre le noyau et le cytoplasme . HDAC3 s'est même avéré interagir avec la membrane plasmique . Le médiateur silencieux pour les récepteurs de l' acide rétinoïque et de l'hormone thyroïdienne (SMRT) et les facteurs de co-répresseur des récepteurs nucléaires (N-CoR) doivent être utilisés par HDAC3 afin de l'activer. Ce faisant, il acquiert la capacité de co-précipiter avec les HDAC 4, 5 et 7. HDAC3 peut également être trouvé complexé avec la protéine liée aux HDAC (HDRP). Les HDAC 1 et 3 se sont avérés médier les interactions Rb-RbAp48, ce qui suggère qu'il fonctionne dans la progression du cycle cellulaire. HDAC3 montre également une implication dans l'auto-renouvellement des cellules souches et un rôle indépendant de la transcription dans la mitose .
HDAC8
HDAC8 s'est avéré être le plus similaire à HDAC3. Sa principale caractéristique est son domaine catalytique qui contient une région NLS au centre. Deux transcriptions de cette HDAC ont été trouvées qui incluent une transcription de 2,0 ko et une transcription de 2,4 ko. Contrairement aux autres molécules d'HDAC, une fois purifiée, cette HDAC s'est révélée enzymatiquement active. À ce stade, en raison de sa découverte récente, on ne sait pas encore s'il est régulé par des complexes protéiques co-répresseurs. Les transferts de Northern ont révélé que différents types de tissus présentent des degrés variables d'expression de HDAC8, mais ont été observés dans les muscles lisses et on pense qu'ils contribuent à la contractilité.
HDAC de classe II
Classe IIA
Les HDAC de classe IIA comprennent HDAC4 , HDAC5 , HDAC7 et HDAC9 . Les HDAC 4 et 5 se sont avérés se ressembler le plus, tandis que HDAC7 conserve une ressemblance avec les deux. Trois variantes de HDAC9 ont été découvertes, notamment HDAC9a, HDAC9b et HDAC9c/HDRP, tandis que d'autres ont été suspectées. Les variantes de HDAC9 présentent des similitudes avec le reste des HDAC de classe IIA. Pour HDAC9, les variantes d'épissage peuvent être considérées comme un moyen de créer un « mécanisme affiné » pour les niveaux d'expression de différenciation dans la cellule. Différents types de cellules peuvent profiter et utiliser différentes isoformes de l'enzyme HDAC9 permettant différentes formes de régulation. Les HDAC 4, 5 et 7 ont leurs domaines catalytiques situés dans l'extrémité C-terminale avec une région NLS tandis que HDAC9 a son domaine catalytique situé dans l'extrémité N-terminale. Cependant, le variant HDAC9 HDAC9c/HDRP n'a pas de domaine catalytique mais présente une similitude de 50 % avec l'extrémité N-terminale des HDAC 4 et 5.
Pour les HDAC 4, 5 et 7, des domaines de liaison conservés ont été découverts qui se lient à la protéine de liaison C-terminale (CtBP) , au facteur d'amplification des myocytes 2 (MEF2) et 14-3-3 . Les trois HDAC agissent pour réprimer le facteur de transcription myogénique MEF2 qui joue un rôle essentiel dans la différenciation musculaire en tant que facteur de transcription de liaison à l'ADN. La liaison des HDAC à MEF2 inhibe la différenciation musculaire, qui peut être inversée par l'action de la kinase Ca 2+ /calmoduline-dépendante (CaMK) qui dissocie le complexe HDAC/MEF2 en phosphorylant la partie HDAC. On a vu qu'ils étaient impliqués dans l' hypertrophie cellulaire dans la différenciation du contrôle musculaire ainsi que dans l'hypertrophie cellulaire dans les tissus musculaires et cartilagineux. Il a été démontré que les HDAC 5 et 7 agissent en opposition à HDAC4 lors de la régulation de la différenciation musculaire afin de conserver un niveau d'expression approprié. Il a été prouvé que ces HDAC interagissent également avec HDAC3 en tant que facteur de co-recrutement des facteurs SMRT/ N-CoR dans le noyau. Il a été démontré que l'absence de l'enzyme HDAC3 entraîne une inactivité, ce qui fait croire aux chercheurs que les HDAC 4, 5 et 7 aident à l'incorporation de recruteurs de liaison à l'ADN pour les complexes HDAC contenant HDAC3 situés dans le noyau. Lorsque HDAC4 est assommé chez les souris, celles-ci souffrent d'une hypertrophie prononcée des chondrocytes et meurent en raison d'une ossification extrême . Il a été démontré que HDAC7 supprime l' apoptose dépendante de Nur77 . Cette interaction conduit à un rôle dans l' expansion clonale des cellules T . Les souris HDAC9 KO souffrent d'hypertrophie cardiaque qui est exacerbée chez les souris double KO pour les HDAC 9 et 5.
Classe IIB
Les HDAC de classe IIB comprennent HDAC6 et HDAC10 . Ces deux HDAC sont les plus étroitement liés l'un à l'autre dans l'ordre global. Cependant, le domaine catalytique de HDAC6 est le plus similaire à HDAC9. Une caractéristique unique de HDAC6 est qu'il contient deux domaines catalytiques en tandem l'un avec l'autre. Une autre caractéristique unique de HDAC6 est le domaine du motif à doigt de zinc (HUB) lié à HDAC6, SP3 et Brap2 dans l'extrémité C-terminale qui montre certaines fonctions liées à l' ubiquitination , ce qui signifie que cette HDAC est sujette à la dégradation. HDAC10 possède également deux domaines catalytiques. Un domaine actif est situé dans l'extrémité N-terminale et un domaine catalytique putatif est situé dans l'extrémité C-terminale avec un domaine NES. Deux domaines putatifs de liaison à Rb ont également été trouvés sur HDAC10, ce qui montre qu'il pourrait jouer un rôle dans la régulation du cycle cellulaire. Deux variantes de HDAC10 ont été trouvées, toutes deux présentant de légères différences de longueur. HDAC6 est le seul HDAC dont il a été démontré qu'il agit sur la tubuline , agissant comme une tubuline désacétylase qui aide à réguler la motilité cellulaire dépendante des microtubules . Il se trouve principalement dans le cytoplasme, mais il est connu qu'il se trouve dans le noyau, complexé avec HDAC11. HDAC10 agit sur les HDAC 1, 2, 3 (ou SMRT), 4, 5 et 7. Certaines preuves ont montré qu'il peut également avoir de petites interactions avec HDAC6. Cela conduit les chercheurs à croire que HDAC10 peut fonctionner davantage comme un recruteur que comme un facteur de désacétylation. Cependant, les expériences menées avec HDAC10 ont effectivement montré une activité de désacétylation.
HDAC de classe IV
HDAC11
Il a été démontré que HDAC11 est apparenté aux HDAC 3 et 8, mais sa séquence globale est assez différente des autres HDAC, ce qui le place dans sa propre catégorie. HDAC11 a un domaine catalytique situé dans son N-terminal. Il n'a pas été trouvé incorporé dans des complexes HDAC tels que Nurd ou SMRT, ce qui signifie qu'il peut avoir une fonction spéciale qui lui est propre. Il a été constaté que HDAC11 reste principalement dans le noyau.
Fonctions biologiques
Règlement de transcription
La découverte de l'acétylation des histones provoquant des changements dans l' activité de transcription remonte aux travaux de Vicent Allfrey et ses collègues en 1964. Le groupe a émis l'hypothèse que les protéines histones modifiées par des groupes acétyle ajoutaient des charges négatives aux lysines positives, et ainsi, réduisaient l'interaction entre ADN et histones . La modification des histones est maintenant considérée comme un mécanisme régulateur majeur qui est impliqué dans de nombreuses étapes différentes des fonctions génétiques. Notre compréhension actuelle est que les résidus de lysine acétylée sur les queues d'histone sont associés à l'activation transcriptionnelle. À leur tour, les histones désacétylées sont associées à une répression transcriptionnelle. De plus, des corrélations négatives ont été trouvées entre plusieurs marques d'acétylation des histones.
Le mécanisme de régulation est considéré comme double. La lysine est un acide aminé avec une charge positive lorsqu'elle n'est pas modifiée. Les lysines sur les queues amino-terminales des histones ont tendance à affaiblir la structure globale de la chromatine. L'ajout d'un groupe acétyle, qui porte une charge négative, supprime efficacement la charge positive et, par conséquent, réduit l'interaction entre la queue d'histone et le nucléosome . Cela ouvre le nucléosome généralement serré et permet à la machinerie de transcription d'entrer en contact avec la matrice d'ADN, conduisant à la transcription du gène . La répression de la transcription des gènes est réalisée par l'inverse de ce mécanisme. Le groupe acétyle est éliminé par l'une des enzymes HDAC pendant la désacétylation, permettant aux histones d'interagir plus étroitement avec l'ADN pour former un assemblage de nucléosomes compacté. Cette augmentation de la structure rigide empêche l'incorporation de la machinerie transcriptionnelle, inhibant efficacement la transcription des gènes.
Une autre implication de l'acétylation des histones est de fournir une plate-forme pour la liaison aux protéines. En tant que modification post - traductionnelle , l'acétylation des histones peut attirer des protéines vers la chromatine allongée qui a été marquée par des groupes acétyle. Il a été émis l'hypothèse que les queues d'histone offrent des sites de reconnaissance qui attirent les protéines responsables de l'activation transcriptionnelle. Contrairement aux protéines du noyau des histones, les queues des histones ne font pas partie du noyau du nucléosome et sont exposées à l'interaction des protéines. Un modèle a proposé que l'acétylation des histones H3 active la transcription des gènes en attirant d'autres complexes liés à la transcription. Par conséquent, la marque acétyle fournit un site de reconnaissance des protéines où les facteurs de transcription interagissent avec les queues d'histone acétylées via leur bromodomaine .
Hypothèse du code histone
L' hypothèse du code Histone suggère l'idée que les modèles de modifications post-traductionnelles sur les histones, collectivement, peuvent diriger des fonctions cellulaires spécifiques. Des modifications chimiques des protéines histones se produisent souvent sur des acides aminés particuliers. Cet ajout spécifique de modifications simples ou multiples sur les noyaux d'histones peut être interprété par des facteurs et des complexes de transcription qui conduisent à des implications fonctionnelles. Ce processus est facilité par des enzymes telles que les HAT et les HDAC qui ajoutent ou suppriment des modifications sur les histones, et des facteurs de transcription qui traitent et « lisent » les codes de modification. Le résultat peut être l'activation de la transcription ou la répression d'un gène. Par exemple, la combinaison de l'acétylation et de la phosphorylation a des effets synergiques sur le niveau global de condensation structurelle des chromosomes et, par conséquent, induit l'activation de la transcription du gène précoce immédiat .
Des expériences portant sur les modèles d'acétylation des histones H4 ont suggéré que ces modèles de modification sont collectivement maintenus dans la mitose et la méiose afin de modifier l'expression des gènes à long terme. Le schéma d'acétylation est régulé par les enzymes HAT et HADC et, à son tour, définit la structure locale de la chromatine. De cette façon, les modèles d'acétylation sont transmis et interconnectés avec la capacité et les fonctions de liaison aux protéines dans la génération cellulaire ultérieure.
Bromodomaine
Le bromodomaine est un motif responsable de la reconnaissance de la lysine acétylée sur les histones par les protéines de remodelage des nucléosomes. Les modifications post-traductionnelles des queues d'histone N- et C-terminales attirent divers facteurs d'initiation de la transcription qui contiennent des bromodomaines, y compris le coactivateur transcriptionnel humain PCAF , TAF1 , GCN5 et CREB-binding protein (CBP), vers le promoteur et ont une importance dans la régulation de l'expression des gènes. L'analyse structurale des facteurs de transcription a montré que les bromodomaines hautement conservés sont essentiels pour que la protéine se lie à la lysine acétylée. Cela suggère que l'acétylation du site d'histone spécifique a un rôle régulateur dans l'activation transcriptionnelle des gènes.
Maladies humaines
Maladies inflammatoires
L'expression des gènes est régulée par l'acétylation et la désacétylation des histones, et cette régulation est également applicable aux gènes inflammatoires. Les maladies pulmonaires inflammatoires sont caractérisées par l'expression de gènes inflammatoires spécifiques tels que NF-κB et le facteur de transcription AP-1 . Les traitements aux corticostéroïdes et à la théophylline pour les maladies pulmonaires inflammatoires interfèrent avec l'activité HAT/HDAC pour désactiver les gènes inflammatoires.
Plus précisément, les données d'expression génique ont démontré une activité accrue de la THA et une diminution du niveau d'activité HDAC chez les patients souffrant d' asthme . Les patients atteints de bronchopneumopathie chronique obstructive ont montré une diminution globale de l'activité HDAC avec des niveaux inchangés d'activité de la THA. Les résultats ont montré qu'il existe un rôle important pour l'équilibre de l'activité HAT/HDAC dans les maladies pulmonaires inflammatoires et ont fourni des informations sur les cibles thérapeutiques possibles.
Cancer
En raison du rôle régulateur lors de la transcription des modifications épigénétiques dans les gènes, il n'est pas surprenant que des changements dans les marqueurs épigénétiques , tels que l'acétylation, puissent contribuer au développement du cancer. L'expression et l'activité des HDAC dans les cellules tumorales sont très différentes de celles des cellules normales. La surexpression et l'augmentation de l'activité des HDAC se sont avérées caractéristiques de la tumorigenèse et des métastases , suggérant un rôle régulateur important de la désacétylation des histones sur l'expression des oncogènes. L'un des exemples est le rôle de régulation de l'acétylation/désacétylation des histones dans P300 et CBP, qui contribuent tous deux à l' oncogenèse .
Approuvé en 2006 par la Food and Drug Administration (FDA) des États-Unis, Vorinostat représente une nouvelle catégorie de médicaments anticancéreux en cours de développement. Vorinostat cible les mécanismes d'acétylation des histones et peut inhiber efficacement le remodelage anormal de la chromatine dans les cellules cancéreuses. Les cibles de Vorinostat comprennent HDAC1 , HDAC2 , HDAC3 et HDAC6 .
La disponibilité des sources de carbone se reflète dans l'acétylation des histones dans le cancer. Le glucose et la glutamine sont les principales sources de carbone de la plupart des cellules de mammifères, et le métabolisme du glucose est étroitement lié à l'acétylation et à la désacétylation des histones. La disponibilité du glucose affecte le pool intracellulaire d'acétyl-CoA, un intermédiaire métabolique central qui est également le donneur d'acétyle dans l'acétylation des histones. Le glucose est converti en acétyl-CoA par le complexe pyruvate déshydrogénase (PDC), qui produit de l'acétyl-CoA à partir du pyruvate dérivé du glucose ; et par l'adénosine triphosphate-citrate lyase (ACLY), qui génère de l'acétyl-CoA à partir du citrate dérivé du glucose. L'activité de la PDC et de l'ACLY dépend de la disponibilité du glucose, ce qui influence ainsi l'acétylation des histones et module par conséquent l'expression des gènes et la progression du cycle cellulaire. La dérégulation de l'ACLY et de la PDC contribue à la reprogrammation métabolique et favorise le développement de plusieurs cancers. Dans le même temps, le métabolisme du glucose maintient le rapport NAD+/NADH et le NAD+ participe à la désacétylation des histones induite par la SIRT. L'activité de l'enzyme SIRT est altérée dans diverses tumeurs malignes, et l'inhibition de SIRT6, une histone désacétylase qui agit sur les H3K9 et H3K56 acétylés, favorise la tumorigenèse. SIRT7, qui désacétyle H3K18 et réprime ainsi la transcription des gènes cibles, est activé dans le cancer pour stabiliser les cellules à l'état transformé. Les nutriments semblent moduler l'activité de la SIRT. Par exemple, les acides gras à longue chaîne activent la fonction désacétylase de SIRT6, ce qui peut affecter l'acétylation des histones.
Dépendance
Les modifications épigénétiques des queues d' histone dans des régions spécifiques du cerveau sont d'une importance centrale dans les dépendances , et une grande partie des travaux sur la dépendance se sont concentrés sur l'acétylation des histones. Une fois que des altérations épigénétiques particulières se produisent, elles apparaissent comme des "cicatrices moléculaires" de longue durée qui peuvent expliquer la persistance des dépendances.
Les fumeurs de cigarettes (environ 21% de la population américaine) sont généralement dépendants de la nicotine . Après 7 jours de traitement à la nicotine des souris, l'acétylation de l'histone H3 et de l'histone H4 a augmenté au niveau du promoteur FosB dans le noyau accumbens du cerveau, provoquant une augmentation de 61 % de l'expression de FosB. Cela augmenterait également l'expression du variant d'épissage Delta FosB . Dans le noyau accumbens du cerveau, Delta FosB fonctionne comme un « commutateur moléculaire soutenu » et une « protéine de contrôle principale » dans le développement d'une dépendance .
Environ 7% de la population américaine est accro à l' alcool . Chez les rats exposés à l'alcool jusqu'à 5 jours, il y a eu une augmentation de l'acétylation de l'histone 3 lysine 9 dans le promoteur de la pronociceptine dans le complexe de l' amygdale cérébrale . Cette acétylation est un marqueur d'activation de la pronociceptine. Le système de récepteurs opioïdes nociceptine/nociceptine est impliqué dans les effets de renforcement ou de conditionnement de l'alcool.
La dépendance à la cocaïne touche environ 0,5% de la population américaine. L' administration répétée de cocaïne chez la souris induit une hyperacétylation de l' histone 3 (H3) ou de l' histone 4 (H4) au niveau de 1 696 gènes dans une région de « récompense » du cerveau [le noyau accumbens (NAc)] et la désacétylation au niveau de 206 gènes. Au moins 45 gènes, montrés dans des études précédentes comme étant régulés à la hausse dans le NAc de souris après une exposition chronique à la cocaïne, se sont avérés être associés à une hyperacétylation de H3 ou H4. Bon nombre de ces gènes individuels sont directement liés aux aspects de la dépendance associés à l'exposition à la cocaïne.
Dans les modèles de rongeurs, de nombreux agents provoquant une dépendance, notamment les produits de la fumée de tabac, l'alcool, la cocaïne, l'héroïne et la méthamphétamine, provoquent des dommages à l'ADN dans le cerveau. Au cours de la réparation des dommages à l'ADN, certains événements de réparation individuels peuvent altérer les acétylations des histones sur les sites de dommages, ou provoquer d'autres altérations épigénétiques, et ainsi laisser une cicatrice épigénétique sur la chromatine . De telles cicatrices épigénétiques contribuent probablement aux changements épigénétiques persistants observés dans les dépendances.
En 2013, 22,7 millions de personnes âgées de 12 ans ou plus avaient besoin d'un traitement pour un problème de consommation de drogues illicites ou d'alcool (8,6 % des personnes âgées de 12 ans ou plus).
Autres troubles
Suggérées par l'idée que la structure de la chromatine peut être modifiée pour autoriser ou refuser l'accès aux activateurs de transcription , les fonctions régulatrices de l'acétylation et de la désacétylation des histones peuvent avoir des implications avec les gènes qui causent d'autres maladies. Les études sur les modifications des histones peuvent révéler de nombreuses nouvelles cibles thérapeutiques.
Sur la base de différents modèles d' hypertrophie cardiaque , il a été démontré que le stress cardiaque peut entraîner des modifications de l'expression des gènes et altérer la fonction cardiaque. Ces changements sont médiés par la signalisation de modification post-traductionnelle HATs/HDACs. Il a été rapporté que la trichostatine A, inhibiteur de HDAC, réduisait l' autophagie des cardiomyocytes induite par le stress . Des études sur l'hypertrophie cardiaque liée à la protéine p300 et CREB et à l'activité cellulaire de la THA suggèrent un rôle essentiel de l'état d'acétylation des histones avec des gènes sensibles à l' hypertrophie tels que GATA4 , SRF et MEF2 .
Les modifications épigénétiques jouent également un rôle dans les troubles neurologiques. La dérégulation de la modification des histones s'avère être responsable de l'expression génique dérégulée et donc associée à des troubles neurologiques et psychologiques, tels que la schizophrénie et la maladie de Huntington . Les études actuelles indiquent que les inhibiteurs de la famille HDAC ont des avantages thérapeutiques dans un large éventail de troubles neurologiques et psychiatriques. De nombreux troubles neurologiques n'affectent que des régions spécifiques du cerveau. Par conséquent, la compréhension de la spécificité des HDAC est toujours nécessaire pour des investigations plus poussées afin d'améliorer les traitements.
Voir également
- Histone acétyltransférase
- Histone désacétylase
- Méthylation des histones
- Acétylation
- Phosphorylation
- Nucléosome
Les références
Liens externes
- Animation de l'acétylation et de la désacétylation de la queue des histones : [1]


